①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2
④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
①分子晶体中都存在共价键; ②在晶体中只要有阳离子就一定有阴离子;
③金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低;
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键;
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti3+和12个O2-相邻;
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合;
⑦晶体中分子间作用力越大,分子越稳定;
⑧氯化钠熔化是离子键被破坏


| 分子 | I2 | HF | F2 | HI |
| 键能(kJ/mol) | 151 | 569 | 153 | 297 |
| A | B | C | D |

 B . 晶格能的大小: Al2O3>MgCl2>NaCl
C . 共价键的键长: F-F>C-Cl>C-S>Si-O
D . 硬度由大到小:金刚石>氮化硅>晶体硅
B . 晶格能的大小: Al2O3>MgCl2>NaCl
C . 共价键的键长: F-F>C-Cl>C-S>Si-O
D . 硬度由大到小:金刚石>氮化硅>晶体硅
当n=2时,AB2属于 分子(填“极性”或“非极性”),分子中有 个π键。A6H6分子中A原子的杂化轨道类型是 杂化。


近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
,
),则原子2和3的坐标分别为、。
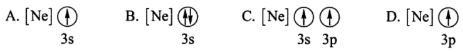
。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。
|
氧化物 |
Li2O |
MgO |
P4O6 |
SO2 |
|
熔点/℃ |
1570 |
2800 |
23.8 |
﹣75.5 |
解释表中氧化物之间熔点差异的原因。

A.共价键 B.离子键 C.金属键 D.分子间作用力
①氢氧化钠熔化;②干冰升华;
③二氧化硅熔化;④钠熔化。
|
金刚石 |
晶体硅 |
晶体硼 |
|
|
熔点(K) |
>3823 |
1683 |
2573 |
|
沸点(K) |
5100 |
2628 |
2823 |
|
硬度 |
10 |
7.0 |
9.5 |
①根据表中数据判断晶体硼的晶体类型属于晶体;
②请解释金刚石的熔沸点高于晶体硅的原因是。