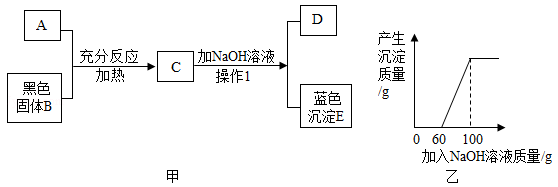
B .
B .  C .
C .  D .
D . 
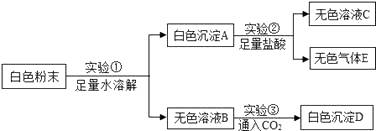
 B .
B .  C .
C .  D .
D . 
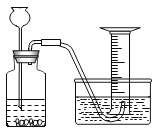
 B .
B .  C .
C .  D .
D . 

| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
下列判断正确的是( )
①R+碱→盐+水 ②R+水→酸
![]()
| 选项 | A | B | C | D |
| 锥形瓶 | MnO2 | HCl气体 | H2O | Zn |
| 胶头滴管 | H2O2 | 石灰水 | 浓H2SO4 | 稀H2SO4 |




|
反应时间(秒) |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
|
|
收集到的气体体积(毫升) |
甲金属 |
25 |
60 |
95 |
130 |
160 |
170 |
170 |
|
乙金属 |
30 |
75 |
120 |
150 |
150 |
150 |
150 |
|


|
物质 |
H2SO4 |
Na2SO4 |
MgSO4 |
|
溶解度/g |
与水任意比互溶 |
19.0 |
39.0 |

①往容器内再加锌粒,如有气泡产生,则溶液中一定有硫酸
②往容器内加氯化钡溶液,如有沉淀生成,则溶液中一定有硫酸
③往容器内再加稀盐酸,如有气泡产生,则溶液中没有硫酸
④将剩余固体加入到硫酸铜溶液中,如有红色固体生成,则溶液中没有硫酸