 B . 收集H2或CO2
B . 收集H2或CO2  C . 高温煅烧石灰石
C . 高温煅烧石灰石  D . 稀释浓硫酸
D . 稀释浓硫酸 



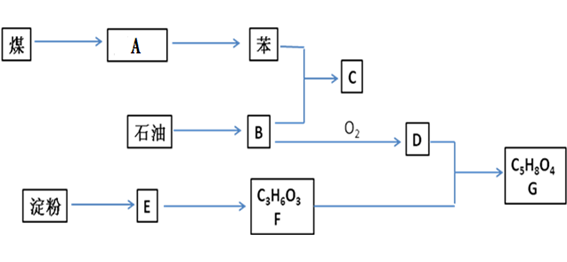
回答下列各题:
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =。
②工业上高炉炼铁反应的平衡常数表达式K =,温度升高后,K值(选填“增大”、“不变”或“减小”)。
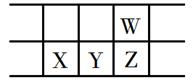
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率

|
时间/s |
10 |
20 |
30 |
40 |
50 |
60 |
|
气体体积/mL |
4 |
14 |
25 |
38 |
47 |
55 |
|
反应速率/mL·s−1 |
0.4 |
1.0 |
1.1 |
? |
0.9 |
0.8 |
表格中的“?”处应填的数据是.
a.容量瓶不干燥
b.定容时俯视容量瓶刻度线
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码)
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处