| 2He | Cl2 | Ca2+ | |
A | 质量数 | 中子数 | 质子数 | 电荷数 |
B | 质量数 | 质子数 | 原子数 | 电荷数 |
C | 质子数 | 中子数 | 原子数 | 电子数 |
D | 质量数 | 质子数 | 分子数 | 电荷数 |

实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸.
实验设计如下
实验步骤 | 实验结论 |
①氯水+1 mL CCl4 , 振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
②NaBr溶液+氯水+1 mL CCl4 , 振荡,静置,观察四氯化碳层颜色 | |
③KI溶液+氯水+1 mL CCl4 , 振荡,静置,观察四氯化碳层颜色 |
下列有关该实验的说法不正确的是( )
①锌为正极,石墨为负极②锌为负极,石墨为正极③工作时,电子由石墨极经过外电路流向锌极④长时间连续使用时,内装糊状物可能流出腐蚀用电器.
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、﹣2 | ﹣2 |
 B .
B .  C .
C .  D .
D . 

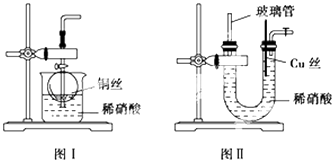
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是(填选项编号).
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是 (填化学方程式)
①长玻璃管的作用是.
②让反应停止的操作方法及原因是.

①X、Y、Z的单质在常温下均为气体;
②X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③XZ极易溶于水,在水溶液中电离出X+和Z﹣ , 其水溶液能使蓝色石蕊试纸变红;
④每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤Z单质溶于X2Y中,所得溶液具有漂白性.
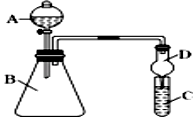
仪器A的名称为,干燥管D的作用为.