B .
B .  C .
C .  D .
D . 
 C . 收集CO2
C . 收集CO2  D . 稀释浓硫酸
D . 稀释浓硫酸 
①Ni+2HCl=NiCl2+H2↑; ②Ni(OH)2+2HCl=NiCl2+2H2O;
③NiO2+4HCl=NiCl2+Cl2↑+2H2O。以下分析正确的是( )
选项 | 物质 | 杂质 | 除杂试剂 | 操作方法 |
A. | CO2 | HCl | 氢氧化钠溶液 | 气体通过盛有足量氢氧化钠溶液的洗气瓶 |
B. | NaCl | Na2CO3 | 硫酸 | 加入少量硫酸、蒸发、结晶 |
C. | CaCO3 | NaCl | 水 | 加入足量水溶解、过滤、洗涤、干燥 |
D. | Cu | CuO | 氧气 | 通入足量氧气并加热 |








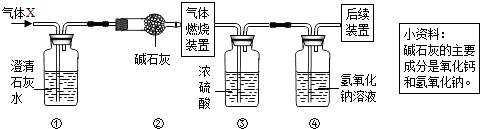







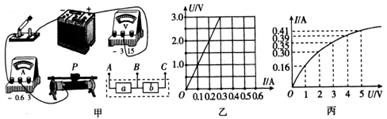
a.NaCl b.HCl c.NaOH
【提出问题】烧杯废液中含有什么物质?
【初步分析】通过分析上述实验现象,烧杯中废液中除酚酞和水外溶质还一定含有。


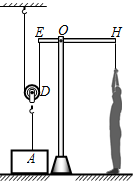
①将刻度尺平放在支座上,左右移动刻度尺,找出能够使刻度尺在水平位置保持平衡的支点位置,记下这个位置,它就是刻度尺的重心;
②如图乙所示,将质量为M1的物体挂在刻度尺左边某一位置,使刻度尺能够在支座上重新保持水平平衡。记录物体悬挂点到支座的距离L1和刻度尺的重心到支座的距离L2;
③根据杠杆的平衡条件,可以计算出刻度尺的质量m=(用题目中所给物理量表示)。


|
实验操作 |
实验现象 |
结论 |
|
Ⅰ取少量的金属粉末于试管中,加入足量的
|
有气泡产生 |
仅除去铝 |
|
Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸 |
|
证明含有铁 |
|
Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 |
剩余固体呈紫红色 |
证明含有铜 |
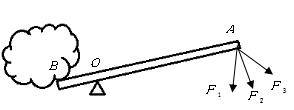
为探究该金属粉末中Al的质量分数,取20g该金属粉末,加入氢氧化钠溶液反应,剩余固体质量与所加氢氧化钠溶液的质量关系如图所示,求:

|
所加盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
每次加盐酸前烧杯及所盛物质的总质量/g |
158.0 |
181.2 |
X |
228.6 |
|
所加盐酸的溶液质量/g |
25.0 |
25.0 |
25.0 |
25.0 |
|
充分反应后烧杯及所盛物质总质量/g |
181.2 |
204.4 |
228.6 |
253.6 |
|
每次生成的二氧化碳质量/g |
1.8 |
1.8 |
Y |
0 |