|
|
|
|
古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
离子组 | 加入试剂 | 离子方程式 | |
A | Al3+、SO42﹣ | 适量Ba(OH)2溶液 | Al3++3OH﹣═Al(OH)3↓ |
B | Fe2+、I﹣ | 足量新制氯水 | Cl2+2I﹣═2Cl﹣+I2 |
C | Fe3+、NO3﹣ | NaHSO3溶液 | 3SO32﹣+2NO3﹣+2H+═3SO42﹣+2NO↑+H2O |
D | Ca2+、HCO3﹣ | 氨水 | Ca2++2HCO3﹣+2NH3•H2O═CaCO3↓+CO32﹣+2NH4++2H2O |
X | Y | Z | 目的 | 装置 | |
A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 |
|
B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
C | 1mol/LNaOH 溶液5mL | 1﹣氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1﹣氯丁烷中含有氯元素 | |
D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
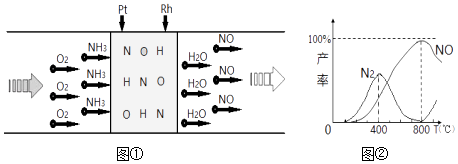
①B能使酸性KMnO4和Br2的四氯化碳溶液均褪色
②试剂a一定是银氨溶液
③J、A的核磁共振氢谱峰面积之比均为3:1
①NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(l)
②2NH2Cl(aq)+HClO(aq)═N2(g)+H2O(l)+3HCl(aq)

Ⅰ.物质NH2Cl中氮元素的化合价是.
Ⅱ.a﹣b点间,溶液中氨氮去除率迅速提高的原因是.
Ⅱ.实验测得,废水中pH与氨氮去除率如图2所示:
pH较高时,氨氮去除率下降的原因是.
pH较低时,氨氮去除率也下降,可能的原因是.
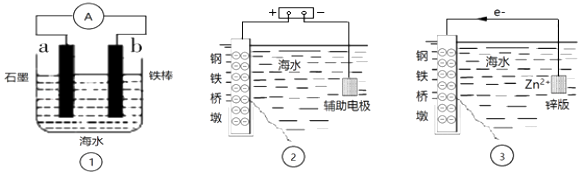
Ⅰ.a极为.
Ⅱ.d极反应式为.

①a反应中每生成1molFeSO4转移电子的物质的量为 mol.
②d反应的离子方程式为.
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是.
②火法冶铜时,由Cu2S制得铜的化学方程式是.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)⇌FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)⇌Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).
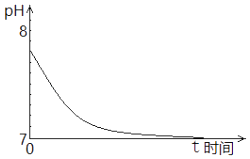
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是.
实验ⅰ
装置 | 操作 | 现象 |
| 向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
实验ⅱ
装置 | 操作 | 现象 |
| 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是.
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是.