
![]()

| 物质 | 苹果汁 | 西瓜汁 | 牛奶 | 鸡蛋清 | 炉具清洁剂 |
| pH | 2.9 | 5.8 | 6.4 | 7.6 | 12.5 |

①实验结论。
②从微观的角度分析,该反应的实质是。
③在滴入稀盐酸的过程中,若观察到有少量气泡出现,请分析产生气泡的可能原因(用化学方程式表示)。
|
实验步骤 |
实验现象 |
结论 |
|
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 |
若 |
稀盐酸过量 |
|
若没有明显现象 |
NaOH溶液与稀盐酸恰好完全反应 |
另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是。
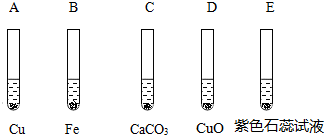
A 铜片 B pH试纸 C 氧化铜 D 紫色石蕊试液
(查阅资料)Ca2+和OH﹣在水溶液中不能大量共存
(提出问题)这瓶NaOH溶液一定变质了,其变质程度如何呢?
(提出猜想)猜想一:NaOH溶液部分变质 猜想二:NaOH溶液完全变质
(实验探究)
|
实验步骤 |
现象 |
结论 |
|
|
步骤一 |
取少量NaOH溶液样品于试管中,向其中滴加过量的CaCl2溶液 |
产生白色沉淀 |
猜想成立 |
|
步骤二 |
过滤,向滤液中滴加酚酞溶液。 |
酚酞溶液变红 |
|
如果步骤一中白色沉淀由两种物质组成,则两种物质是(填化学式);步骤二中根据酚酞溶液变红这一现象证明样品中含有(填字母)。
A.CaCl2 B.Na2CO3 C.NaOH D.Na2CO3和NaOH
下列物质①BaCl2溶液、②Ca(NO3)2溶液,③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代步骤一中CaCl2溶液的是(填序号)。
(提出问题)实验室有一瓶久置的NaOH,变质程度怎样?
(设计方案)先称取21.2g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数.
(进行实验)实验测得加入稀硫酸的质量与产生CO2气体的质量关系如下图所示.

(数据处理)写出以下计算过程: