| 选 项 | 归 类 | 物 质 |
| A | 氧化物 | 水、干冰、氯化镁 |
| B | 常见合金 | 青铜、焊锡、氧化铁 |
| C | 可燃气体 | 氢气、氧气、天然气 |
| D | 直接构成物质的微粒 | 原子、分子、离子 |
 检查气密性
B .
检查气密性
B .  比较金属活动性
C .
比较金属活动性
C .  验证燃烧需O2
D .
验证燃烧需O2
D .  验证质量守恒定律
验证质量守恒定律


| 实验目的 | 方法一 | 方法二 | |
| A | 鉴别食盐水和蒸馏水 | 测导电性 | 加入肥皂水 |
| B | 检验铜粉中混有铁粉 | 加入稀盐酸 | 加入硫酸铜溶液 |
| C | 除去CO2中混有的CO | 通入适量O2 , 点燃 | 通过灼热的氧化铁 |
| D | 分离MnO2、KCl固体 | 溶解、过滤 | 蒸发 |
A、氮气 B、活性炭 C、氢气 D、不锈钢 E、石灰石 F、武德合金 G、硬铝 H、钢铁







| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为183.1g |
(交流讨论)
①应该选择组的实验数据来计算确定组成.最终计算结果表明:该红色粉末的组成是假设(填序号)成立。
②写出A装置中发生反应的化学方程式;实验中观察到A装置中的现象为。
③为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?请判断并说明理由:。
①从环保角度,该装置有严重不足之处。你认为应该如何改进?。
②实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是。
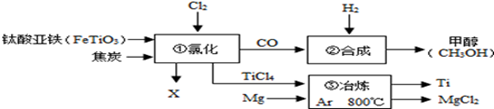
③工业上用2000t含氧化铁75%的赤铁矿,可炼出含铁97%的生铁吨?(结果保留一位小数)

 B . 利用金属的年代:
B . 利用金属的年代:  C . 铜元素的质量分数
C . 铜元素的质量分数  D . 元素的含量
D . 元素的含量 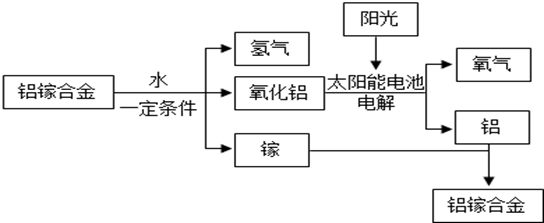
①此流程中,铝镓(Ga)合金(填“可以”或“不可以”)循环使用;
②写出铝镓合金与水反应的化学方程式。
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应。
①请完成证明金属粉末中存在Fe和Cu的实验设计:
|
实验操作 |
实验现象 |
结论 |
|
I.取少量的金属粉末于试管中,加入足量的氢氧化钠溶液 |
|
仅除去铝 |
|
II.将试管静置,弃去上层清液,加入足量的(填试剂名称)。 |
|
证明含有铁 |
|
III.将试管静置,弃去上层清液,多次洗涤剩余固体 |
剩余固体呈紫红色 |
证明含有铜 |
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量。实验过程中得到的部分数据与图象如下:

| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 17.3 | n | 11.9 | … |
I以上数据可知,上表中n的值为;
II该金属粉末中Al的质量分数为%

请回答下列问题: