
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| 溶液 | 实验现象 | 实验结论 | | |
| A | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 | |
| B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
| C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
| D | 紫色石蕊试液 | 溶液先变红, 后褪色 | SO2的水溶液呈酸性, 且SO2有漂白性 |


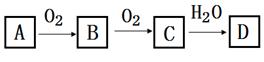
①D的化学式是;
②在工业生产中,B气体的大量排放被雨水吸收后形成了而污染了环境。
①A、C的化学式分别是:A;C 。
②请写出C→D的反应化学方程式 。该反应与中,氧化剂与还原剂的物质的量之比为。
|
主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
① |
② |
③ |
|||||
|
3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
|
4 |
⑨ |
⑩ |
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:a → (按气流方向,用小写字母表示)。

③ 氨气的催化氧化的化学方程式为

写出 NO2 被吸收过程的离子方程式: 。

a为浓盐酸,b为MnO2 , c为饱和食盐水, d为30%KOH溶液,e为NaOH溶液
回答下列问题:
①装置I中反应的化学方程式为 。
②若取消装置II,对本实验的影响是 。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和。
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10, 滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去ClO-的离子方程式是。
②样品中KClO3的貭量分数为。(保留三位有效数字,KClO3式量:122.5)