操作 | 现象 | 结论 | |
A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42﹣ |
C | 滴加氯水和CCl4 , 振荡、静置 | 下层溶液显紫色 | 原溶液中有I﹣ |
D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
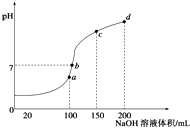
根据以上信息回答下列问题:
|
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
CuCl产率/% |
70 |
90 |
82 |
78 |
75 |
72 |
70 |
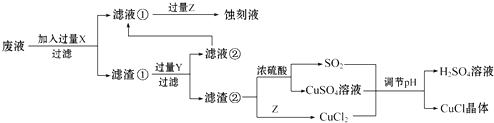
析出CuCl晶体最佳pH为,当pH较大时CuCl产率变低原因是.调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是.
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
|
平行实验次数 |
1 |
2 |
3 |
|
0.25g样品消耗硫酸铈标准溶液的体积(mL) |
24.35 |
24.05 |
23.95 |
则样品中CuCl的纯度为(结果保留三位有效数字).
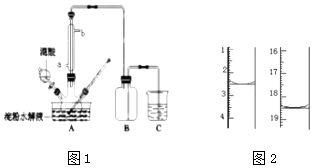
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体.硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
用KMnO4标准溶液滴定,该反应的离子方程式为:,称取该样品加适量水完全溶解,然后用0.02000mol•L﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图2,则消耗KMnO4溶液的体积为.

①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H=.
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式:.
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L﹣1、c(H2)=0.4mol•L﹣1、c(CH3OH)=0.8mol•L﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为,达到平衡时CO的转化率为.
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
b.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c( Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
CO的结构可表示为CO,元素Y的单质Y2的结构也可表示为YY.如表是两者的键能数据(单位:kJ•mol﹣1):
A﹣B | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明CO比Y2活泼的原因:.
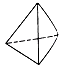
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是.
A.Y4为一种新型化合物
B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高
D.1mol Y4气体转变为Y2将放出954.6kJ热量.
①能发生水解反应
②与FeCl3溶液能发生显色反应
③苯环上有两种不同化学环境的氢原子
注:合成路线的书写格式参照如图示例流程图:
CH3CHO CH3COOH
CH3COOCH2CH3 .