
| 选项 | A | B | C | D |
| 名称 | 250 mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
| 图形 | | | | |
| 用途与使用操作 | 配制1.0 mol·L-1NaCl溶液,定容时仰视刻度,则配得的溶液浓度小于1.0 mol·L-1 | 用酒精萃取碘水中的碘,分液时,碘层需从上口放出 | 可用于量取10.00mL Na2CO3溶液 | 蒸馏实验中将蒸气冷凝为液体 |
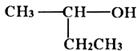


下列说法正确的是( )

原理如下:(1− x)LiFePO4+xFePO4+LixCn LiFePO4+nC。
下列说法不正确的是( )
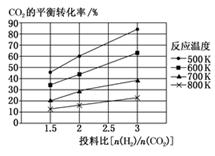
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1 , ΔH1=
①ΔH1(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会(填“增大”“减小”或“不变”,下同),平衡常数K会。
反应原理为2CO(g)+SO2(g)=2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
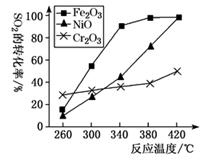
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是
②若在2 L恒容密闭容器中,将3 mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是(填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2

回答下列问题:



①实验室也可用 B 装置制备 NO,X装置的优点为
②检验装置气密性并装入药品,打开K2 , 然后再打开K3 , 通入一段时间气体,其目的是,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
①设计实验证明 HNO2是弱酸:。(仅提供的试剂:1 mol•L-1盐酸、1mol•L-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是,亚硝酰氯(ClNO)的质量分数为。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10 , Ksp(Ag2CrO4)=1×10-12)
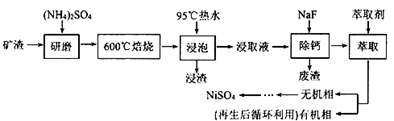
已知(NH4)2SO4在350℃分解生成NH3和H2SO4 , 回答下列问题:

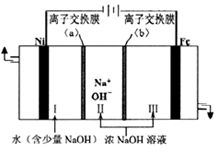
图甲 图乙
①电解时阳极的电极反应式为,离子交换膜(b))为(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为。
a.盐酸 b.FeCl3溶液 C. NaHCO3溶液 d.浓溴水