
①容器内混合气体的平均相对分子质量不再变化; ②容器内气体分子个数不再发生变化;
③容器内气体的压强不再发生变化; ④v正(NO):v逆(N2):V逆(CO2)=4:2:1
①滴入酚酞,NaNO2溶液显红色
②用HNO2溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强
④0.1 mol·L-1 HNO2溶液的pH=2
⑤HNO2与CaCO3反应放出CO2气体
⑥c(H+)=0.1 mol·L-1的HNO2溶液稀释至1000倍,pH<4

过程I:2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2 kJ/mol
过程II:……
下列说法不正确的是( )



(已知:Ksp(ZnS)=3×10-25mol2/L2)
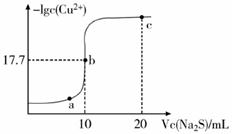


上述盐溶液中的阴离子,结合质子能力最强的是。
A.HCN B.HClO C.H2CO3 D.CH3COOH
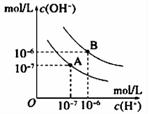
95℃时水的电离平衡曲线应为(选填“A”或“B”);

已知:N2(g)+O2(g) 2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) △H=-564 kJ·mol-1
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=。
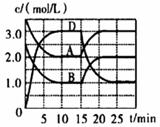
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将 (填“向左”、“向右”或“不”)移动。
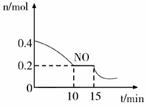
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
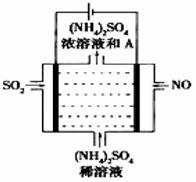
如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为g。

①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:

试回答下列问题:
①判断达到滴定终点的依据是:;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)。