| 物质 | a | b | c | d |
| 反应前的质量/g | 40 | 40 | 10 | 32 |
| 反应后的质量/g | 12 | x | 10 | 0 |
下列说法正确的是( )

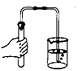 检查装置气密性
B .
检查装置气密性
B .  熄灭酒精灯
C .
熄灭酒精灯
C . 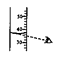 量取液体
D .
量取液体
D . 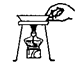 移走蒸发皿
移走蒸发皿
![]()



|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
|
溶解 度/g |
Li2SO4 |
36.1 |
35.4 |
34.8 |
34.3 |
33.9 |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
|
请回答下列问题:


①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A②④ B①③⑤ C③④ D①②⑤

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 4.2 | 9.1 |
| 完全沉淀 | 3.2 | 6.7 | 11.1 |

合理猜想其它化合物为:i.NaOH;ii.H2O2;iii.NaOH和H2O2;小明做出以上猜想的理论依据是
|
实验步骤 |
实验现象 |
实验结论 |
|
步骤 1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌。 |
固体完全溶解,形成无色溶液 |
/ |
|
步骤 2:取少量步骤1 形成的溶液于试管中,再加入,振荡,静置。 |
白色沉淀 |
含有 Na2CO3 |
|
步骤 3:取少量步骤 2 试管中的上层清液于另一支试管中,再滴加少量MgCl2 溶液,振荡。 |
无明显现象 |
|
|
步骤 4:另取一支试管,加入少量步骤 1 形成的溶液,再加入,将带火星木条伸入试管中。 |
|
含有 H2O2 |
[查阅资料]①过氧化钙固体难溶于水,加热至315℃时开始分解,完全分解的温度为400~425℃。
②常温下过氧化钙干燥且很稳定。过氧化钙能溶于稀酸生成过氧化氢,过氧化钙在湿空气或水中会逐渐缓慢地分解,长时间放出氧气。
[实验一]提纯碳酸钙

已知:“转化”步骤中的反应方程式为:CaCl2+NH3+CO2+H2O=CaCO3↓+2NH4Cl
已知:①CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O+2NH4Cl;
②CaO2•8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2。

为控制沉淀的温度为0℃左右,在实验室宜采取的方法为。
a 冰水 b 40℃热水 c 饱和NH4Cl溶液
该活动小组设计下列装置,通过测定生成O2的体积,计算样品中CaO2的质量分数。

已知:a.CaO2+2HCl=CaCl2+H2O2 b.杂质不与盐酸反应生成气体
实验中MnO2的作用是。
为防止过氧化钙在空气中变质,应保存。