 D .
D . ①少量Cl2通入FeI2溶液中:Cl2+2I‾=2Cl‾+I2
②Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
③向次氯酸钙溶液中通入少量SO2:Ca2++2ClO‾+H2O+SO2=CaSO3↓+2HClO
④FeBr2溶液与等物质的量Cl2反应:2Fe2++2Br‾+2Cl2=2Fe3++4Cl‾+Br2
⑤向小苏打溶液中加入过量的澄清石灰水:HCO ![]() +Ca2++OH‾=CaCO3↓+H2O
+Ca2++OH‾=CaCO3↓+H2O
⑥硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO ![]() +Ba2++OH‾=BaSO4↓+H2O
+Ba2++OH‾=BaSO4↓+H2O
⑦Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH‾+O2↑

 可用于制取氨气
B .
可用于制取氨气
B .  可验证酸性HCl>H2CO3>H2SiO3
C .
可验证酸性HCl>H2CO3>H2SiO3
C .  可用于吸收尾气中少量NH3或HCl,并防止倒吸
D .
可用于吸收尾气中少量NH3或HCl,并防止倒吸
D .  可用于从酒精水溶液中制取无水乙醇
可用于从酒精水溶液中制取无水乙醇

| 选项 | 表述I | 表述II |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | Cl2和SO2有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| D | SiO2有导电性 | SiO2可用于制光导纤维 |

 挤压装置的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B .
挤压装置的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B .  挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C .
挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C .  用鼓气装置从装置的a处不断鼓入空气并打开止水夹
D .
用鼓气装置从装置的a处不断鼓入空气并打开止水夹
D .  在装置的水槽中慢慢加入足量浓硫酸并打开止水夹
在装置的水槽中慢慢加入足量浓硫酸并打开止水夹
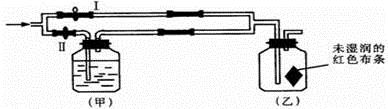
发生反应的化学方程式是;
发生反应的化学方程式是;
D中收集到的物质是,检验该物质的方法和现象是.
(用化学方程式和必要的文字加以说明)

①装置B中加入的试剂,作用是。
②装置D加入的试剂,装置F加入的试剂。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是。
④U型管G的作用为.
反应②的化学方程式是;
反应后的溶液与足量的D反应的离子方程式是,如何检验最后溶液中的阳离子:。