| 酸性氧化物 | 酸 | 盐 | 混合物 | 电解质 |
A | SiO2 | HClO | 烧碱 | KAl(SO4)2•12H2O | C2H5OH |
B | Na2O2 | HNO3 | NaHSO4 | 漂白粉 | Mg |
C | SO3 | H2SiO3 | 纯碱 | 水玻璃 | NaCl |
D | NO | Al(OH)3 | BaCO3 | 铝热剂 | NH3 |
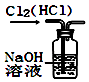 用图所示装置除去Cl2中的HCl
B .
用图所示装置除去Cl2中的HCl
B . 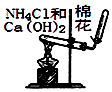 用图所示装置实验室制NH3
C .
用图所示装置实验室制NH3
C . 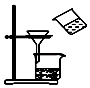 用图所示装置分离MnO2和KCl
D .
用图所示装置分离MnO2和KCl
D . 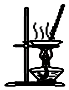 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
序号 | 实验操作 | 实验现象 | 实验结论 |
A | 向某无色溶液中滴加盐酸 | 产生能使澄清石灰水变浑浊气体 | 说明溶液中一定含有CO32﹣ |
B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 说明溶液中一定含有SO42﹣ |
C | 向某溶液中先滴加KSCN溶液,再滴加氯水 | 先无明显现象,后出现血红色溶液 | 说明溶液中一定含有Fe2+ |
D | 向一定浓度的Na2SiO3溶液中通入适量的CO2 | 出现白色沉淀 | 说明H2CO3的酸性比H2SiO3强 |
|
选项 |
X |
Y |
Z |
箭头上所标数字的反应条件 |
|
A |
SiO2 |
Na2SiO3 |
H2SiO3 |
①与Na2CO3熔融 |
|
B |
Na |
Na2O2 |
NaCl |
②加H2O |
|
C |
NO |
NO2 |
HNO3 |
③与C加热 |
|
D |
Al2O3 |
NaAlO2 |
Al(OH)3 |
④与NaOH |
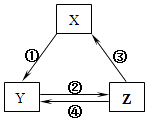
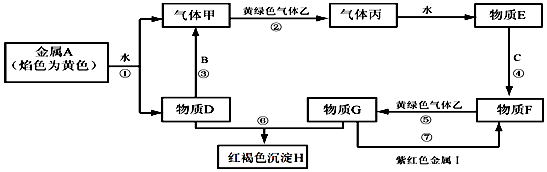
请根据以上信息回答下列问题:
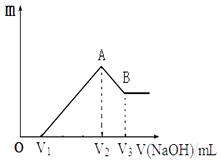
写出反应⑤的离子方程式:;写出反应⑦的离子方程式:.
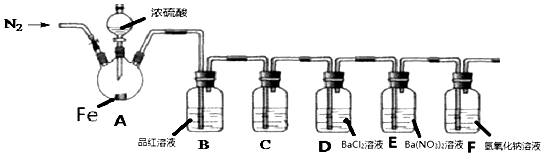
实验开始前,先打开弹簧夹通一段时间N2 , 关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生.已知A中白雾是硫酸与水形成的酸雾.请回答下列问题:

①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦500mL容量瓶 ⑧细口试剂瓶
请回答下列问题:
上述浓硫酸体积为mL.
⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为,从上述所给仪器中选取
所需要的仪器有.