 D . 冷凝管
D . 冷凝管 

 B .
B .  C .
C .  D .
D . 

![]()
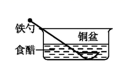
则制备溴代环戊烷的装置最好选择( )
 B .
B .  C .
C .  D .
D . 
![]() + HCl
+ HCl
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
P4+ NaOH+H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为。
请回答下列问题:
烟道气中的SO2 , 也可通过如下反应回收硫:2CO(g)+SO2(g) S(s)+2CO2(g) + Q kJ。某温度下,在2 L恒容密闭容器中通入2 mol SO2和一定量的CO,发生上述反应,5 min后达到平衡,生成1 mol CO2。

a.若混合气体密度保持不变,则反应已达平衡状态
b.从反应开始到平衡时,容器内气体的压强保持不变
c.平衡时,其它条件不变,分离出硫,正反应速率加快
d.平衡时,其它条件不变,再充入一定量CO2 , 平衡常数保持不变

已知:①1molB与足量NaHCO3溶液反应生成标准状况下的CO2 44.8L
②乙炔与甲醛1:2反应生成C

请回答下列问题:


请回答下列问题:
MgO2产品中常会混有少量MgO,实验室可通过多种方案测定样品中MgO2的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中MgO2的含量。

②2H2O2 → 2H2O +O2↑,稀盐酸中加入少量FeCl3溶液的作用是。