 )的分析,正确的是( )
)的分析,正确的是( )
 不能发生化学反应的是( )
不能发生化学反应的是( )
 D . 1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
D . 1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高




氮原子核外能量最高的电子所处的轨道是:。锂离子核外电子的轨道表示式是:。
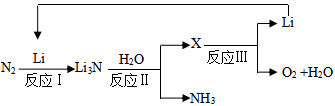
每合成1mol氨,转移电子mol;该过程最终得到的氧化产物是。

①制备过程中,证明已有丙烯酸生成的方法是:。
②证明生成的丙烯酸中混有丙烯醛的方法是:。
方案Ⅰ.①称量:仪器X的质量为ag;②称量:仪器X和装有试样的质量为bg;③加热;④冷却;⑤称量:仪器X和残余物的质量为cg;⑥重复____________操作,直至恒重,质量为dg。

为提高测定准确性,应选用发生装置(选填“A”或“B”)和量气装置D;装置D比装置C准确性高的原因是(任一条原因)。
用密度为1.19g/mL、质量分数为0.37的浓盐酸,配制1L0.1000mol/L稀盐酸,所需的定量仪器是:滴定管、1L容量瓶,其中滴定管的作用是。滴定管和容量瓶在使用前都要进行的操作是。(选填序号)
Y.检漏 Z.用蒸馏水洗涤 W.用待装液润洗
|
滴定次数 |
样品的质量/g |
稀盐酸的体积/mL |
|
|
滴定前读数 |
滴定后读数 |
||
|
1 |
0.2570 |
1.00 |
21.01 |
|
2 |
0.2570 |
0.50 |
20.49 |
|
3 |
0.2570 |
1.20 |
21.20 |