|
选项 |
实验方案、现象 |
结论 |
|
A |
用玻璃棒蘸取某样 品进行焰色反应,观察到黄色火焰 |
该样品中一定含钠元素 |
|
B |
将石蜡油(液态石蜡)分解的产物通入溴的四氯化碳溶液中,溶液逐渐褪色 |
分解产物中一定含有乙烯 |
|
C |
向酸性KMnO4溶液中先通入少量SO2 , 充分反应后,再滴入几滴BaCl2溶液,产生白色沉 |
SO2被氧化为SO42- |
|
D |
向FeCl3 溶液中加入过最的KI溶液,充分反应后,再滴入几滴KSCN溶液,溶液颜色变红 |
KI与FeCl3的反应为可逆反应 |



已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
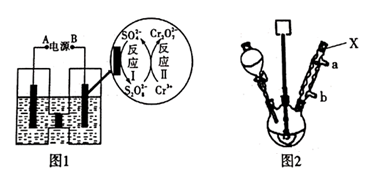
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4 , 析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是,冷却水应从口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用法完成。
⑤该合成技术的优点是实现了(填化学式)的循环利用,绿色环保。
|
第一次 |
第二次 |
第三次 |
第四次 |
|
|
体积( mL) |
23.00 |
23.10 |
21.40 |
22.90 |

已知:①UO22+在pH为4-5的溶液中生成UO2(OH)2沉淀;②Fe2+和Fe3+沉淀完全的pH分别为9.7、3.7。
①3CH3CH2CH=CH2(g) 4CH3CH=CH2(g) △H=+579 kJ·mol-1
②CH3CH2CH=CH2(g) 2CH2=CH2(g) △H=+283 kJ·mol-1
回答下列问题:


A ④②①③ B ④②③① C ①②④③ D ①④③②
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为。砷酸的酸性弱于硒酸,从分子结构的角度解释原因。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为,画出配离子的结构式(不考虑立体构型)。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为。
②铬的晶胞结构如图A所示,它的堆积模型为,在该晶胞中铬原子的配位数为。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA , 则碳化钨晶体的密度是g·cm-3(列出计算表达式)。


已知:①RCOOH RCOCl
②H3C-CHO H3C-CH=CH-COOH
