

| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向 3mL0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液 | 先出现白色沉 淀后出现黄色 沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 将某气体通入品红溶液 | 品红溶液褪色 | 该气体是 SO2 |
| C | 用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH | 后者 pH比前者 的小 | 非金属性:Cl>C |
| D | 将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中 | 溶液变蓝 | 氧化性Fe3+>Cu2+ |

| 温度 | | | | | |
| 平衡气体总浓度 | | | | | |
下列有关叙述正确的是( )



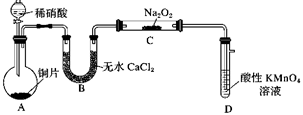


仪器 A 的名称,导管 b 的作用。
②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表。
|
序号 |
实验操作 |
实验现象 |
|
1 |
向 10mL 1mol·L-1 的 Na2S 溶液中通 O2 |
15min 后,溶液才出现浑浊 |
|
2 |
向 10mL 1mol·L-1 的 Na2S 溶液中通 SO2 |
溶液立即出现黄色浑浊 |
由实验现象可知:该实验条件下 Na2S 溶液出现浑浊现象是 SO2 导致的。你认为上表实验 1 反应较慢的原因可能是。
[查阅资料] ①实验进行 5min,样品中的 S 元素都可转化为 SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
工业设定的滴定终点现象是。
实验二:加入 1g 样品再进行实验,5min 后测得消耗标准液体积为 V2mL
比较数据发现 V1 远远小于 V2 , 可忽略不计 V1。 测得 V2 的体积如表
|
序号 |
1 |
2 |
3 |
|
KIO3 标准溶液体积/mL |
10.02 |
9.98 |
10.00 |
该份铁矿石样品中硫元素的质量百分含量为。
a.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H1= -574kJ/mol
b.CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:。
②有利于提高 NOx 的平衡转化率的反应条件是:(至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ∆H2=kJ/mol
A.催化剂活性降低 B.平衡常数变大 C.副反应增多


II.有人利用反应 2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。

用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp= (计算表达式表示); 已知:气体分压(P 分)=气体总压(P 总)×体积分数。



| 温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在温度区间铵明矾基本上失去了全部结晶水。
 ,设计由乙醇和
,设计由乙醇和  的合成线路。(无机试剂任选)
的合成线路。(无机试剂任选)