| A | B | C | D |
| | | | |
| 明矾做净水剂 | 丙烯制造聚丙烯熔喷布 | 氨气制造液氨冷却剂 | 含碳酸氢钠的抗酸药治疗胃酸过多 |
 ,可用乙酸与过氧化氢一定条件下反应制得。下列说法错误的是( )
,可用乙酸与过氧化氢一定条件下反应制得。下列说法错误的是( )




| A | B | C | D | |
| 实验 | | | | |
| 现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
| 结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |

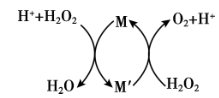
①将铜阳极泥在空气中焙烧使碲转化为TeO2;
②用NaOH溶液碱浸;
③以石墨为电极电解②所得溶液获得Te。
已知:TeO2微溶于水,易与较浓的强酸、强碱反应
下列说法错误的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| 5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
| 10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
| 15min浓度(mol•L-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是,CH3OH的平衡转化率是。
反应i(主反应):CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H=+49kJ•mol-1
反应ii(副反应):H2(g)+CO2(g) CO(g)+H2O(g)△H=+41kJ•mol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是。
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为,随着温度的升高,催化剂对(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是。


阳极的电极反应式是。
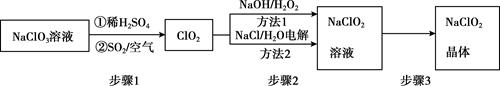
已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
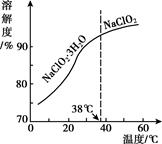
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol•L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaClO2的质量分数为。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是(用离子方程式和文字表示)。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
|
装置 |
实验序号 |
实验操作 |
实验现象 |
|
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
| 实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
| 实验III | 1.向试管中滴加1mL0.1mol•L-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
