 C . Na2S的电子式:
C . Na2S的电子式:  制CO2
B .
制CO2
B .  净化CO2
C .
净化CO2
C .  制取并收集NH3
D .
制取并收集NH3
D .  制CaCO3
制CaCO3





①NaBH4与水反应所得溶液呈碱性,原因是。
②随着反应的进行,生成H2的速率逐渐减慢,原因是。

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是。
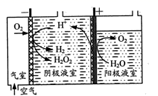
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:。
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是。

H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) ∆H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) ∆H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) ∆H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H= 。该反应的催化剂为 。
①弱碱性条件下·OH将H2PO2-氧化成PO43- , 理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3 , 其中一份再加入FeSO4。反应相同时间,实验结果如图所示:

添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是。
![]()


 、CH3CH2CH2NH2中所含官能团的名称分别为 、 。
、CH3CH2CH2NH2中所含官能团的名称分别为 、 。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
②取其中一份溶液,调节溶液pH在6~8之间。加入0.1000 mol/LI2的标准溶液25.00 mL,充分反应后滴入2~3滴指示剂X,用0.1000 mol/LNa2S2O3标准溶液滴定至蓝色恰好褪去,发生反应: 。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
③向另一份溶液中加入NH3·H2O-NH4Cl缓冲溶液,加热至70℃左右,滴入2-3滴指示剂PAN,用0.02500 mol/LEDTA (Na2H2Y)标准溶液滴定其中Cu2+(离子方程式为Cu2++H2Y2--=CuY2-+2H+),消耗EDTA标准溶液28.00 mL。
指示剂X为 。
CH3CH2CH2CHO

![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。

步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。