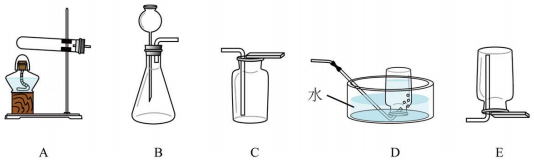
| 气体 | 方法(或原理) | 发生装置 | 收集装置 |
| O2 | 方法1:加热氯酸钾 | 均可选择A装置 (可根据需要添加棉花) | 均可选择④装 置(填标号) |
| 方法2:加热①(填化学式) | |||
| 方法3:分解过氧化氢溶液 | 均可选择②装置(填标号) | ||
| CO2 | 化学方程式为③ |
|
方案 |
现象 |
结论 |
|
方案1:将带火星的木条分别伸入两个集气瓶中 |
若带火星的木条① |
则该瓶气体是O2 |
|
方案2:向两个集气瓶中分别滴入少量的②溶液,振荡 |
若溶液变浑浊 |
则该瓶气体是CO2 |
|
方案3:向两个集气瓶中分别倒入少量的水,振荡后再滴加几滴紫色石蕊溶液 |
若紫色石蕊溶液变为③色 |
则该瓶气体是CO2 |
|
…… |
…… |
…… |
甲、a→b→c 乙、b→a→c 丙、c→a→b

“原料气”中N2的制备:N2约占空气体积的五分之,可通过分离液态空气的方法得到。
【查阅】他得知在KClO3分解制O2的反应中,Fe2O3可作催化剂。
【实验】他用电子秤称取0.49gFe2O3和一定量的KClO3 , 充分混合后加热至KClO3完全分解,冷却至室温,称得剩余固体的质量为1.98g。
【计算】①剩余固体中KCl的质量是g。
②该反应生成O2的质量(根据化学方程式写出完整的计算步骤)。
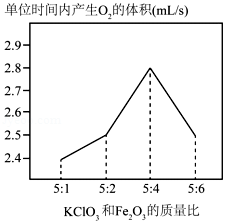
【思考】他发现制备O2较慢,猜测KClO3和Fe2O3的质量比可能会影响反应的快慢。
【探究】③他调节KClO3和Fe2O3的质量比制备O2 , 整理数据绘制出如图,从图中得出KClO3和Fe2O3最佳质量比是。
【结论】④根据质量守恒定律,请你计算出小圳同学在【实验】中称取的KClO3的质量为g,KClO3和Fe2O3的质量比是(填最简比),不是最佳质量比。