 :2-甲基戊烷
:2-甲基戊烷
 的说法,不正确的是( )
的说法,不正确的是( )

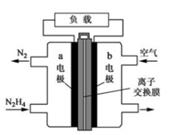
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍,下列判断不正确的是( )
| 温度/K | t/min n/mol | t1 | t2 | t3 | t4 |
| T1 | n(Y) | 0.14 | 0.12 | 0.10 | 0.10 |
| T2 | n(Y) | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )

①X与足量稀硝酸反应,得到气体1和溶液2
②溶液2中滴加足量的氨水,得到有色沉淀3
下列说法正确的是( )

请回答下列问题:
X中除钾元素外还含有元素、。(填元素名称)
C(s)+2NO(g) N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度时间的变化如表所示:
| 时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.60 | 0.60 |
| N2 | 0 | 0.42 | a | b | 1.20 | 1.20 |
| CO2 | 0 | 0.42 | a | b | 1.20 | 1.20 |
①0-20min内的平均反应速率v(CO2)=mol/(L·min)。
②30min时只改变某一条件,则可能的变化是(填字母编号)。
a.升高温度
b.降低温度
c.再通入一定量的NO
d.缩小容器的体积
e.加入合适的催化剂
f.增大容器体积

反应1:BaSO4(s)+4C(s) 4CO(g)+BaS(s) △H=+571.2kJmol-1
反应2:BaSO4(s)+4C(g) 4CO2(g) +BaS(s) △H=-18.8kJmol-1
①保持温度不变,若t2时刻将容器体积减小为一半,t3时刻达到新的平衡,请在下图继续画出t2~t4区间c(CO)的变化曲线。

②科学家将大量排放的CO2作为新碳源的研究引起国际关注,以新型的二氧化钛为催化剂,可以将CO2和CH4直接转化成乙酸。催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。

实验室制备Mg(ClO3)2·3H2O的过程如图1:

已知四种化合物的溶解度(S)与温度(T)的变化曲线关系如图2所示:

反应原理的离子方程式:ClO3-+Ag++3NO2-=AgCl↓+3NO3-
①能与NaOH反应
②-NH2直接与苯环连接
 的合成路线(无机试剂及溶剂任选)。
的合成路线(无机试剂及溶剂任选)。