①体系的温度不再变化 ②外界条件不变时,A,B,C浓度保持不变 ③气体平均分子量不再变化 ④体系的压强不再变化 ⑤气体密度不再变化 ⑥3 v正(B)=2 v逆(C) ⑦单位时间内消耗1 mol A(g)的同时生成3 mol C(g)
① 单位时间内生成n mol O2的同时生成2n mol NO2
② v正(NO)=v逆(O2)
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态
①容器内温度不变 ②混合气体的密度不变
③混合气体的压强不变 ④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变 ⑥容器内A、C、D三种气体的浓度之比为2∶1∶1
⑦某时刻υ(A) =2υ(C)且不等于零 ⑧单位时间内生成n mol D,同时生成2n mol A


下列说法正确的是
②
③
则 的
(用含
、
、
的代数式表示)。
①下列说法正确的是(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
②达到平衡时 的浓度为1.4 mol·L−1 , 充入一定量的
,反应再次达到平衡,
浓度(填“
”“
”或“
”) 1.4 mol·L−1。

① (填“
”“
”或“
”)0;比较
、
、
的大小:。
②若初始时通入 ,
为
,则
点平衡常数
(用气体平衡分压代替气体平衡浓度计算,分压
总压
气体的物质的量分数,写出计算式即可)。
A(s)+O2(g)=CO2(g) △H=-393.51kJmol-1
B(s)+O2(g)=CO2(g) △H=-395.41kJ·mol-1
则两种同素异形体中较稳定的是(填“A”或“B”)。
用甲烷制备合成气还可以发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g) ;△H2=+216kJ·mol -1。
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x, 将此混合气与足量CH4充分反应。
若x=0.2时,反应①放出的能量为kJ;
若x=时,反应①与②放出(或吸收)的总能量为0。
3A(g)+B(g) xC(g) ,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为;x为。可以作为达到平衡状态的标志是 。
A.单位时间内生成nmol B的同时生成3nmolA
B.混合气体的压强不变
C.混合气体的颜色不再改变(C为有色气体)
D.混合气体的密度不变


②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ,请写出此反应的热化学方程式,K1、K2、K3之间的关系是。
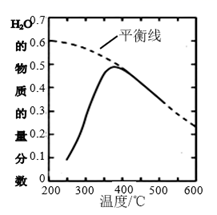
①该反应的平衡常数K随温度降低而(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

①阳极反应式是。
②结合电极反应式,简述K2CO3溶液的再生原理。