下列说法正确的是( )
|
选项 |
离子方程式 |
评价 |
|
A |
|
正确, |
|
B |
|
正确, |
|
C |
将少量的 |
正确, |
|
D |
将 |
错误, |
|
离子或化合物 |
Cr2O | Cr(OH)3 | Cr3+ | CrO2- | CrO |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:
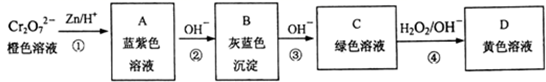
①写出反应④的离子方程式:。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为。
第一步:用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应Na2SO3+CaO+H2O=CaSO3↓+2NaOH
若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的离子方程式
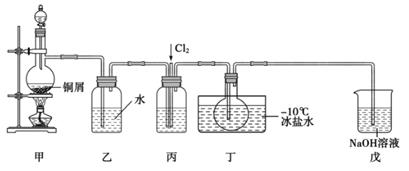
(已知:NO+NO2+2NaOH=2NaNO2+H2O)
①它们核外电子总数都相同;
②N 溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y 核内质子总数比K多两个;
④X和N 都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失
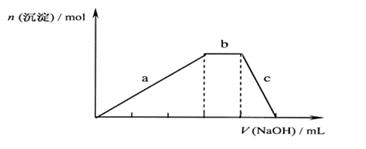
NaOH 溶液,出现了如右图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为
通入氧气在标准状况下的体积 mL