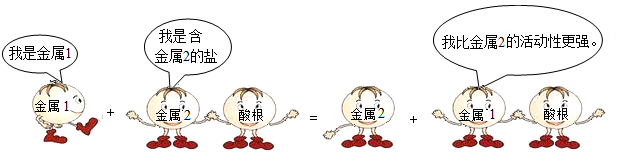
①比较硬度,硬度小的是“愚人金”
②灼烧 ,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡产生的是“愚人金”
④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
| 化学式 | 水溶性 | 酸碱性 | 热稳定性 | 和稀盐酸作用 |
| NaNO2 | 100℃时的溶解度为163g | 弱碱性 | 320℃以上会分解,放出带刺激性气味的气体 | 放出红棕色气体 |
| NaCl | 100℃时的溶解度为39.12g | 中性 | 受热不分解 | 不反应 |
①除去二氧化碳中混有的少量氧气,可以通入一氧化碳后点燃,将氧气转化为二氧化碳;
②实验室用6%的氯化钠溶液配制3%的氯化钠溶液,量取6%的氯化钠溶液时俯视读数,若其他操作均正确,则所配溶液中溶质的质量分数大于3%;
③某固体可能由氯化钠、硫酸钠、氯化钡、氯化镁、硫酸钾中的一种或几种组成,取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解,则该固体的组成有5种情况;
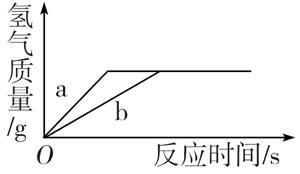
④某碳酸钠溶液中可能含有另一种溶质,取一定量该溶液,逐滴滴加稀盐酸,产生气体的体积与加入稀盐酸的体积关系如图所示,则该碳酸钠溶液中一定含有氢氧化钠。

【查阅资料】硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
【实验与探究】
|
内容 |
现象 |
实验解析 |
结论 |
|
|
实验一 |
|
| 化学方程式是:K2CO3+H2SO4=K2SO4+H2O+CO2↑ | 生成物中有气体或有或有沉淀生成时,复分解反应可以发生 |
| 实验二 |
| 溶液颜色由红色恰好变为无色 | | |
| 实验三 | | 产生白色沉淀 | 该反应的实质是:Ba2++ |
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是。
【拓展与应用】将稀盐酸、Ca(OH)2溶液、NaCl溶液和Na2CO3溶液任意两种溶液相混合,写出能发生反应且有沉淀生成的化学方程式:。
【查阅资料】钠常温下就能与水发生剧烈反应,反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表中所示。
|
实验编号 |
钠块大小 |
硫酸铜溶液 |
实验中产生沉淀的现象 |
|
① |
绿豆大小 |
稀溶液10mL |
产生蓝绿色沉淀 |
|
② |
绿豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀 |
|
③ |
豌豆大小 |
稀溶液10mL |
产生蓝色絮状沉淀 |
|
④ |
豌豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
【实验结论】
【实验反思】实验中生成氢氧化铜沉淀的原理是。
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由:。
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。
结论:碳酸氢钠溶液呈性。
【实验方案】设计实验装置如图,并进行实验。

现象:试管口有水珠,澄清石灰水变浑浊。充分加热后,试管中有白色固体剩余。
结论:碳酸氢钠受热有、水和白色固体生成。
试管①中反应的化学方程式为。
小洪的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3或的混合物。
Ⅰ.他的依据是。
Ⅱ.小洪的同学为了确定反应后的固体产物成分,进行以下实验,请填写表格:
| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物一定是NaOH |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 |
| 固体产物含有Na2CO3 |
| 实验三:取实验二所得的上层清液于试管中,滴加 |
| 固体产物是Na2CO3 , 而不是NaOH |
【讨论与评价】实验一的结论与实验二的结论相反,在讨论时,小洪认为实验一的结论不正确,她的理由是。试写出碳酸氢钠受热发生反应的化学方程式:。
【拓展与应用】根据以上探究,请说出碳酸氢钠在日常生活中的一种用途:。
【提出问题】该湖盐样品的成分是什么?
【查阅资料】冬天捞碱的“碱”指Na2CO3 , 夏天晒盐的“盐”指NaCl。
【猜想与假设】猜想一:Na2CO3;
猜想二:NaCl;
猜想三:Na2CO3和NaCl。
|
实验 |
实验操作 |
实验现象 |
实验结论 |
|
实验一 |
取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 |
产生能使澄清石灰水变浑浊的气体 |
①猜想不成立 |
|
实验二 |
②向实验一所得的溶液中加入适量的 |
③ |
猜想三成立 |

反应结束之后通入空气的目的是。