|
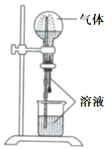
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |
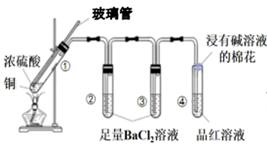
| 试管 | ① | ② | ③ | ④ |
| 实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 品红溶液褪色 |
将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。
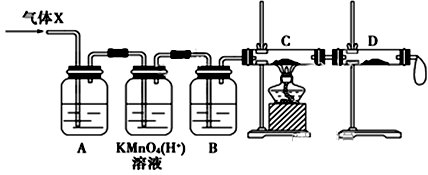
①酸性KMnO4溶液的作用是;B中添加的试剂是。
②装置C中所装药品为,可证实气体X中混有较多量某杂质气体的实验现象是。
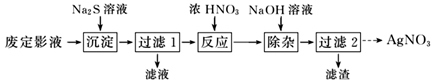
“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是。
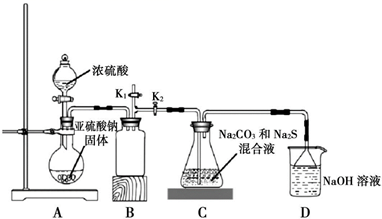
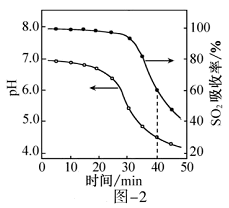
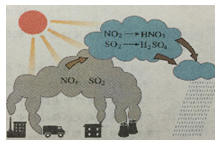
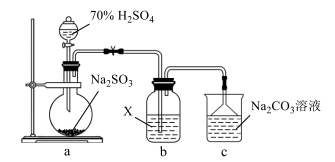
依据图示回答下列问题:
装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是,装置 B 的作用是。
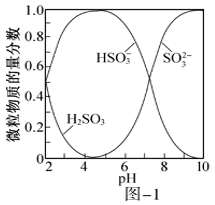
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。