
选项 | 生产活动 | 知识解读 |
A | 用干冰进行人工降雨 | 干冰升华吸热 |
B | 用生石灰作食品干燥剂 | 生石灰吸水,易与水反应 |
C | 向葡萄酒中通入少量 |
|
D | 利用氢氟酸刻蚀石英制作艺术品 | 氢氟酸可与 |

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
|
A | 浓硫酸 | 光亮铝条 | 铝条完全溶解 | |
B |
|
| 溶液先变棕黄,后出现气泡 | |
C | 稀硝酸 | 铜屑 | 瓶中立刻产生无色气体 | |
D | 浓氨水 |
| 先生成白色沉淀后又溶解 |
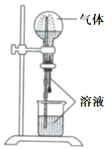
|
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |

①无色溶液中:K+、Cl-、Na+、HCO、OH-
②使pH试纸变深蓝色的溶液中:K+、CO、Na+、AlO
③水电离的c(H+)=10-12mol·L-1的溶液中:ClO-、HCO、NO
、NH
、SO
④加入Mg能放出H2的溶液中:Mg2+、NH、Cl-、Na+、SO
⑤使甲基橙变红的溶液中:MnO、NO
、SO
、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO、Cl-、SO



、
、
、
、
, 现取三份100mL溶液进行如下实验:
第一份加入溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.03mol气体;
第三份加足量溶液后,得到干燥沉淀4.30g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。综合上述实验,你认为以下结论正确的是( )


①第一步反应是(填“放热”或“吸热”)反应。
②1mol全部氧化成
的热化学方程式是。
物质 | |||
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=。
①燃烧木炭取暖②C与反应制取水煤气③煅烧石灰石(主要成分是
)制生石灰④氯化铵晶体和
混合搅拌⑤食物因氧化而腐败

①非金属元素氢化物的稳定性与氢化物的生成热的关系为。
②硫化氢发生分解反应的热化学方程式为。

已知;①ClO2有类似Cl2的性质;②实验室常用稳定剂吸收ClO2 , 生成NaClO2 , 使用时加酸只释放出ClO2一种气体;③草酸100 ℃可以升华,150℃左右开始分解。请回答下列问题:
a.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
b.装置e主要用于检验是否有Cl2生成
c.仪器f的主要作用是防止倒吸

①生成Ca(ClO)2的化学方程式为。
②“氯化”时要适当减缓通入Cl2速率的目的是。
①滤渣的主要成分为、(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]1∶5(填“>”、“<”或“=”)。
