| 选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
| A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | |
| B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
| C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
| D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |

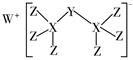
| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①Na2CO3熔融 |
| B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
| C | N2 | NO2 | HNO3 | ③加热 |
| D | C | CO | CO2 | ④灼热炭粉 |
| 选项 | ① | ② | ③ | 实验结论 | |
| A | 浓硫酸 | Na2SO3 | KMnO4 溶液褪色 | SO2有漂白性 | |
| B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
| C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
| D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A | B | C | D | |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
①离子半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si ⑦金属性:Be<Mg<Ca<K
| 选项 | 事实 | 推测 |
| A | CaCO3和BaCO3都难溶于水 | SrCO3也难溶于水 |
| B | Si是半导体材料,同族的Ge也是半导体材料 | 第ⅣA族的元素的单质都可作半导体材料 |
| C | HCl在1 500 ℃时分解,HI在230 ℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |



| 目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 |
| 装置 | | |
| 选项 | A | B |
| 目的 | 在铁制品上镀铜 | 构成原电池 |
| 装置 | | |
| 选项 | C | D |


①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
使盐酸与NaOH溶液混合均匀的正确操作是________(填字母)。
|
实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
氢氧化钠溶液 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=(结果保留一位小数)。
|
化学键 |
H—H |
Br—Br |
I—I |
Cl—Cl |
H—Cl |
H—I |
H—Br |
|
键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
1 mol H2在2 mol Cl2中燃烧,放出热量kJ。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在Cl2中放热(填“多”“少”或“不变”)。

A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
①下列有关电解精炼说法正确的是。
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式。

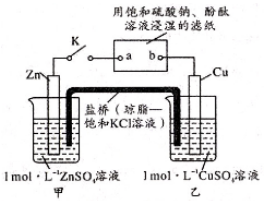
装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为.
①电源的M端为极;甲烧杯中铁电极的电极反应为.
②乙烧杯中电解反应的离子方程式为.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为mL.

纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
①上述装置中D电极应连接肼燃料电池的极(填“A”或“B”)
②该电解池的阳极反应式为
③当反应生成14.4g Cu2O时,至少需要肼 mol。
