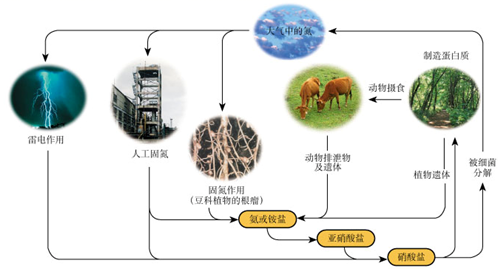
 B . 干燥NH3
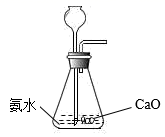
B . 干燥NH3  C . 收集NH3并验满
C . 收集NH3并验满  D . 尾气处理
D . 尾气处理 
![]()
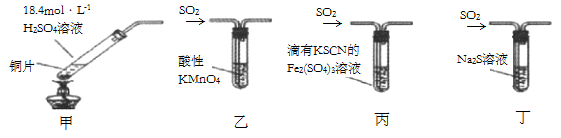
| 实验方案 | 实验I: | 实验II: |
| 实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
![]()
A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
已知:气体的沸点 :
℃,
:21℃

a.烧碱
b.二氧化锰
c.生石灰
d.氯化铵
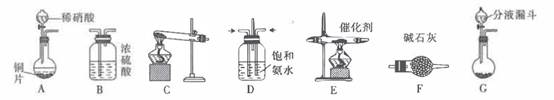
(二)NH3的制取
下列有关实验室制备氨气的说法正确的有(填序号)
①用氮气与氢气反应制取氨气
②用排饱和食盐水的方法收集氨气
③实验室制氨气有时需要加热,有时不需要加热
④用无水氯化钙干燥氨气
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
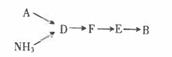
A装置中反应的离子方程式为。
![]()
①NO→NO2 的现象是, NO2→HNO3 的化学方程式为。
②将HNO3 转化为 Ca(NO3)2 , 列举两种不同类别的化合物 M(写化学式) 。
②实验室检验某化肥是铵态氮肥,检验过程中发生反应的离子方程式为。
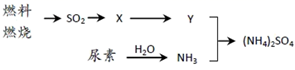
①X可能是SO3 或,Y是。
②尿素CO(NH2)2是一种常用有机氮肥,缓慢与 H2O 发生非氧化还原反应释放出NH3和另外一种气体,该反应的化学方程式为。

已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。