①混合物:盐酸、漂白粉、氯水、水银:
②化合物: CaCl2、 NaOH、HCl、 HD
③电解质:明矾、石膏、冰醋酸、氯化银
④同素异形体: C60、 C70、 金刚石、石墨
①石英的主要成分是二氧化硅
②三峡大坝使用了大量水泥,水泥是硅酸盐材料
③太阳能电池的主要成分是硅,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,所以可用来制造电子部件和光学器件
⑤水玻璃中含有三种元素,主要用来制备硅胶和木材防火剂

| ①中的物质 | ②中的物质 | 预测①中现象 | |
| A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
| B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
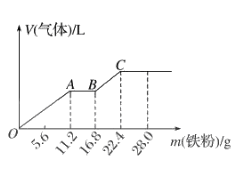
| 选项 | 实验操作 | 现象 | 结论 |
| A | 漂白粉溶液通入一定量的SO2 | 产生白色沉淀 | 发生复分解反应,生成了 CaSO3 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的 Al2O3薄膜,且Al2O3熔点高于Al |
| C | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液 | 实验开始立即产 生白色沉淀 | X是Na2SO3 |
| D | 浓磷酸滴入食盐中,微热 | 产生无色刺激性气味气体 | 磷酸酸性强于盐酸 |



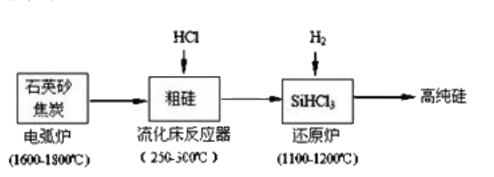
SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_。
|
物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
|
熔点/℃ |
1410 |
-70.4 |
-126.5 |
-122 |
-118 |
-114.2 |
-185 |
|
沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
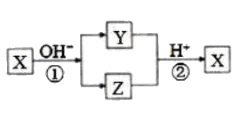
写出上述实验中②的离子方程式:。
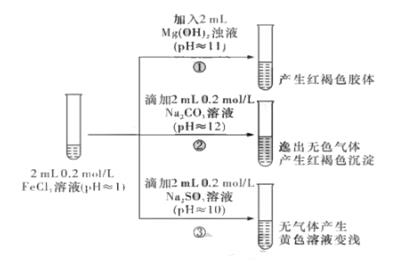
①中反应的离子方程式是._。
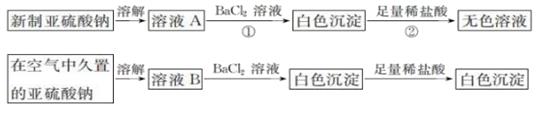
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液, 产生白色沉淀。得出结论:
FeCl3与Na2SO3 发生了氧化还原反应,离子方程式是_。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_。

①A中所用的试剂为。
②实验室用Na2SO3和硫酸制备SO2 , 可选用的气体发生装置是(选填编号)。

③B处反应管内五球中玻璃棉上的活性炭的作用为催化剂,D处U形管中盛放的试剂为其作用是:。

①钛的配位数为,原 子的杂化类型。
②该配合物中存在的化学键有 ( 填字母代号)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
|
TiCl4 |
TiBr4 |
TiI4 |
|
|
熔点/℃ |
-24.1 |
38.3 |
155 |
|
沸点/℃ |
136. 5 |
233. 5 |
377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是。

