a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整.
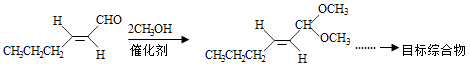
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L﹣1 . 我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L﹣1 . 某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH﹣═2MnO(OH)2↓
酸性条件下,MnO(OH)2将I﹣氧化为I2:②MnO(OH)2+I﹣+H+→Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2;③2S2O32﹣+I2═S4O62﹣+2I﹣
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2 .
b.向烧瓶中加入200mL水样.
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量)开启搅拌器,至反应①完全.
d.搅拌并向烧瓶中加入2mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性.
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol•L﹣1 Na2S2O3溶液进行滴定,记录数据.f…
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化).
回答下列问题:
①滴定管 ②注射器 ③量筒
H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=0(填“>”或“=”)
a.容器内气体压强保持不变
b.吸收ymol H2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.
①电解一段时间后,c(OH﹣)降低的区域在(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为.
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因.