| A | B | C | D | |
| 实验目的 | 制备氢氧化铁胶体 | 实验室制备氨气 | 除去CO2中的少量HCl | 推断S、C、Si的非金属性强弱 |
| 实验装置 | | | | |
| 选项 | 实验目的 | 实验操作 |
| A | | 实验结束时,先停止通 |
| B | 探究 | 先检验 |
| C | 分解 | 实验结束时,先停止加热,再从水槽中拿出导气管 |
| D | 用 | 静置后,先将上层溶液从分液漏斗上口倒出 |

| 甲 | 乙 | 丙 | 丁 | |
| A | H2SO4 | Na2SO4 | NaOH | NaCl |
| B | KCl | K2CO3 | KOH | HCl |
| C | O2 | CO | CuO | C |
| D | Zn | FeCl2 | Cu | HCl |

下列说法正确的是( )
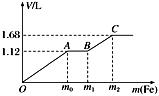
则第二步转化的反应方程式是。
Ⅰ.稀硝酸不能氧化 ,而浓硝酸能将
氧化成
.
Ⅱ.稀硝酸与磷化物反应时,只能将磷元素氧化成单质磷,而浓硝酸与磷化物反应时,能将磷元素氧化成 .
Ⅲ.稀硝酸只能将 氧化成单质碘,而浓硝酸则能把
氧化成
Ⅳ.……
回答下列问题:

已知:氢氧化钠溶液不与 反应,能与
反应生成
和
.
①B的作用是,B中反应的离子方程式为.
②实验时,首先将a和b相连接,C中的试剂为,C中观察到的现象是.
然后将a与c相连接,其目的是,E中观察到的现象是.

回答下列问题:
a.用 溶液洗涤再蒸馏
b.升华
c.重结晶
d.加入少量锡屑再蒸馏
e.过滤
| 质量比/ m(H2O)∶m(SrO) | 4∶1 | 5∶1 | 6∶1 | 7∶1 | 8∶1 | 9∶1 | 10∶1 |
| | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
| | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |