 B . 小气球变瘪
B . 小气球变瘪  C . 验证Fe、Cu、Ag
C . 验证Fe、Cu、Ag  D . U型管内液面左高右低
D . U型管内液面左高右低  的金属活动性强弱
的金属活动性强弱
| 选项 | 单质 | 氧化物 | 有机物 | 混合物 |
| A | 铝合金 | 四氧化三铁 | 醋酸 | 空气 |
| B | 水银 | 水 | 硝酸铵 | 冰水混合物 |
| C | 金刚石 | 干冰 | 乙醇 | 生理盐水 |
| D | 铜 | 生石灰 | 纯碱 | 煤 |


 B . 向NaOH和BaCl2的混合溶液中滴加H2SO4溶液
B . 向NaOH和BaCl2的混合溶液中滴加H2SO4溶液  C . 将水通电一段时间
C . 将水通电一段时间
 D . 向一定量的氢氧化钠溶液中逐滴加入pH=2的稀硫酸至过量
D . 向一定量的氢氧化钠溶液中逐滴加入pH=2的稀硫酸至过量

 B . 铁架台
B . 铁架台  C . 橡胶塞
C . 橡胶塞  D . 蒸发皿
D . 蒸发皿 

①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3;⑤加过量的BaCl2;⑥蒸发。
正确的顺序是( )

 B .
B .  C .
C .  D .
D . 
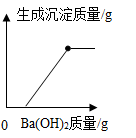 B .
B . 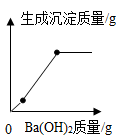 C .
C . 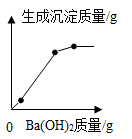 D .
D . 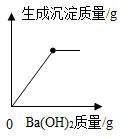


BC段沉淀减少的化学方程式是。





【查阅资料】
⑴白色的无水硫酸铜粉末遇水变成蓝色。
⑵Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl、H2O、CO2。
【实验假设】①可燃气体只是CO ②可燃气体只是H2 ③可燃气体是CO、H2的混合气。
【实验过程】实验小组按以下流程进行实验

实验中,发现黑色氧化铜变红,且无水硫酸铜变蓝色,还观察到澄清石灰水变浑浊,证明水煤气的组成为(填实验假设的序号)。
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是。
【实验拓展】实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余,但丙同学认为乙同学的设计是错误的,理由是(用化学方程式解释)。
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na+2H2O═2NaOH +H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如下表所示。
|
实验编号 |
钠块大小 |
硫酸铜溶液 |
实验中产生沉淀的现象 |
|
① |
绿豆大小 |
稀溶液10mL |
产生蓝绿色沉淀 |
|
② |
绿豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀 |
|
③ |
豌豆大小 |
稀溶液10mL |
产生蓝色絮状沉淀 |
|
④ |
豌豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
a.上述实验中均未观察到色固体生成,由此判断猜想一错误
b.实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
a.实验中生成氢氧化铜沉淀的原理是。
b.由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。
c.为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水旒酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由。.


| 项目 | 参数 |
| 整车质量(千克) | 20 |
| 共享电单车最大功率(瓦) | 200 |
| 骑车人质量(千克) | 50 |
样 品 | 第 1 份 | 第2份 | 第3份 | 第4份 |
取样品质量(g) | 25.0 | 25.0 | 25.0 | 25.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.2 | 0.4 | 0.5 | m |
试计算:

|
装置丙 |
装置丁 |
|
|
反应前 |
48.8g |
161.2g |
|
反应后 |
46.5g |
163.9g |
小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为g,氧化铜的纯度为%。