 B . 除杂、干燥
B . 除杂、干燥 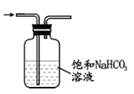 C . CO2与锌粉反应
C . CO2与锌粉反应  D . 检查 CO
D . 检查 CO 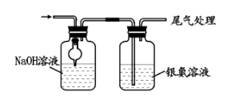
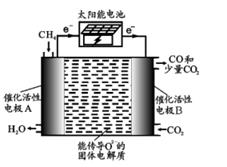
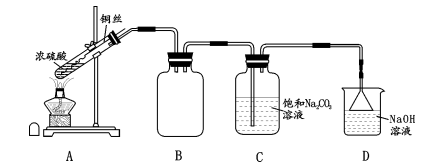
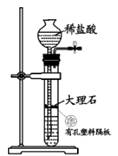
实验步骤:
①按图连接装置,检查装置气密性;
②装入药品,加热 A中试管,C中反应至pH=4.1停止加热,将 A中铜丝外移脱离浓硫酸;
③将 C中液体转移至蒸发装置中,加热,结晶脱水、过滤、洗涤、干燥.
试回答下列问题:
① 取100.00mL饮料于锥形瓶中,加入0.0100mol/L的I2溶液V1 mL,塞紧瓶塞充分反应.
② 打开瓶塞,将锥形瓶内液体调至接近中性,滴加4~5滴淀粉溶液变蓝. 用0.100mol/L的 Na2S2O3 溶 液 滴 定,滴 定 至 终 点 时,消 耗 Na2S2O3溶 液V2 mL,饮 料 中 残 留 的 Na2S2O5为 mg/L. 若滴定前溶液pH 调至大于10,则残留的 Na2S2O5测定值(填“偏高”、“偏低”或“无影响”).
(已知:S2O52- +2I2+3H2O=2SO42- +4I- +6H+ 2S2O32- +I2=S4O62- +2I- )
试回答下列问题:
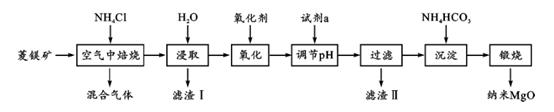
已知在该条件下金属离子开始沉淀和完全沉淀的pH 如下:
|
金属离子 |
Fe2+ |
Fe3+ |
Mg2+ |
|
开始沉淀pH |
6.3 |
1.5 |
8.9 |
|
完全沉淀pH |
8.1 |
2.8 |
10.9 |
上述流程中“氧化”是否可省掉及理由是 .
② 4NH3(g) +5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;则4NH3(g) +6NO(g)=5N2(g)+6H2O(l)的 ΔH 为.
N2(g) +3H2(g) 2NH3(g) ΔH<0
用传感器测得温度为T1、T2时容器中 (N2)随时间变化如下表:
|
|
0 |
5min |
10min |
15min |
20min |
|
T1 |
0.1mol |
0.08mol |
0.062mol |
0.05mol |
0.05mol |
|
T2 |
0.1mol |
0.07mol |
----- |
xmol |
0.06mol |
①T2时,0~5min内 NH3平均速率为v(NH3)=;
②T1时,该反应平衡常数为 (列出计算式);
③ x 0.06(填“>”、“<”或“=”),原因是.
污染物. 反应机理如下[Pt(s)表示催化剂,右上角带“·”表示吸附状态]:
Ⅰ NO + Pt(s)=NO*
Ⅱ CO + Pt(s)=CO*
Ⅲ NO*=N* + O*
Ⅳ CO* + O*=CO2+ Pt(s)
Ⅴ N* + N*=N2+ Pt(s)
Ⅵ NO* + N= N2O+ Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化关系如图一和图二所示:
图一 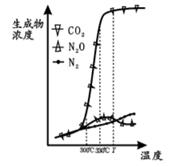 图二
图二 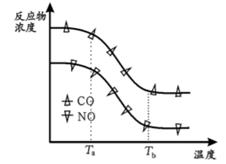
①图一,温度为33℃时发生的主要反应为 (填 “Ⅳ ”、 “Ⅴ ” 或 “Ⅵ ”); 反 应 Ⅵ 为反应(填“放热”或“吸热”).
②图二, 温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
③气体在固体催化剂表面反应中,吸附和解吸同时影响总反应速率. 温度一定时,反应2NO +2CO N2+2CO2的反应速率随强的变化如图所示. 结合(3)中反应机理,试从吸附和解吸角度解释 bc段化学反应速率下降的原因 .

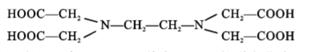
①EDTA 中电负性最大的元素是,其中 C原子轨道杂化类型为 ;
②EDTA 存在的化学键有 (填序号).
a. 离子键 b. 共价键 c. 氢键 d.σ键 e.π键 f. 配位键
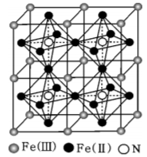
已知晶体的密度为ρg·cm-3 , 阿伏加德罗常数为 NA.
①该结构中单纯分析铁的堆积,其堆积方式为;
②该铁氮化合物的化学式为;
③计算 Fe(Ⅱ)构成正八面体的体积为cm3.

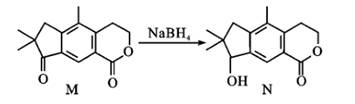
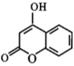 的同分异构体中,满足下列条件 ①除苯环外,没有其它环;②苯环上只有两个取代基;③能与 NaHCO3溶液反应生成气体;④遇 FeCl3溶液显紫色的同分异构体共有种;其中核磁共振氢谱有四组峰,面积比为2∶2∶1∶1的结构简式为
的同分异构体中,满足下列条件 ①除苯环外,没有其它环;②苯环上只有两个取代基;③能与 NaHCO3溶液反应生成气体;④遇 FeCl3溶液显紫色的同分异构体共有种;其中核磁共振氢谱有四组峰,面积比为2∶2∶1∶1的结构简式为