 C . 一定量氯化钠中的n个氯离子:nCl-
D . 金刚石中的60个碳原子:C60
C . 一定量氯化钠中的n个氯离子:nCl-
D . 金刚石中的60个碳原子:C60
![]()
 检查装置气密性
B .
检查装置气密性
B . 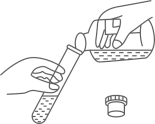 倾倒液体
C .
倾倒液体
C .  加热液体
D .
加热液体
D .  蒸发食盐水
蒸发食盐水

 向氢氧化钠溶液中滴加氯化铁溶液:无色溶液中产生氢氧化铁白色沉淀
B .
向氢氧化钠溶液中滴加氯化铁溶液:无色溶液中产生氢氧化铁白色沉淀
B .  一氧化碳与灼热的氧化铁反应:红棕色粉末逐渐变为黑色粉末
C .
一氧化碳与灼热的氧化铁反应:红棕色粉末逐渐变为黑色粉末
C .  铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,产生黑色固体
D .
铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,产生黑色固体
D .  研磨氯化铵与熟石灰粉末:白色固体中产生刺激性气味的气体
研磨氯化铵与熟石灰粉末:白色固体中产生刺激性气味的气体

|
选项 |
实验目的 |
所用试剂或操作方法 |
|
A |
鉴别稀盐酸、NaOH溶液、K2CO3 溶液、NaCl溶液 |
取样,相互滴加,观察现象 |
|
B |
除去CO中的HCl气体 |
将气体通过NaOH溶液,再通过浓硫酸 |
|
C |
验证甲烷中含有碳、氢两种元素 |
点燃甲烷,在火焰上方罩一内壁附着石灰水的烧杯,观察现象 |
|
D |
分离碳酸钠和氯化钠的混合物 |
加入适量氯化钙溶液,过滤,蒸发 |



A降温到着火点以下
B隔绝氧气
C清除可燃物


A 图2中b点所示溶液中的溶质是NaCl和NaOH;
B 取图2中d点所示溶液加热蒸干所得固体为纯净物
C 图2中c→d所示溶液中NaCl的质量不断增加;
D 图3中e→f变化趋势可说明该反应是放热反应。


(作出猜想)A 石灰水已经完全变质 B 气体中有挥发出来的HCl气体
(实验探究)小组同学设计了如下实验来验证。请你帮助完成实验,填写以下表格:
|
实验步骤 |
实验现象 |
实验结论 |
|
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡 |
|
猜想A不成立 |
|
②将生成的气体通入溶液中 |
产生白色沉淀 |
气体中有HCl 猜想B成立 |
(拓展延伸)如果用上述原料制取一瓶干燥纯净的二氧化碳气体,所选仪器的连接顺序为B→()→()→C(填字母序号)。
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为。
|
编号 |
操作 |
现象 |
|
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象 |
|
乙 |
将表面打磨后的铝丝浸入CuSO4溶液中 |
铝丝表面析出红色固体 |
|
丙 |
将表面未打磨的铝丝浸入CuCl2溶液中 |
铝丝表面析出红色固体 |
比较实验乙和实验(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
|
操作 |
现象 |
结论 |
推论 |
|
①向一支试管中再加入 NaCl固体 |
铝丝表面析 出红色固体 |
氧化铝薄膜 被破坏 |
Na+或能 破坏氧化铝薄膜 |
|
②向另一支试管中再加入 Na2SO4固体 |
|
氧化铝薄膜 未被破坏 |
Na+和SO42-都不能 破坏氧化铝薄膜 |
得出结论:前述猜测(填“正确”或“不正确”)。总结反思:本次探究充分运用了比较法和控制变量法。
|
气体发生装置内物质的总质量(g) |
|
|
反应前 |
35.6 |
|
反应后 |
34.8 |