 B .
B .  C .
C .  D .
D . 
实验操作 | 实验现象 |
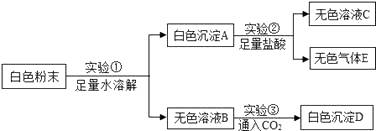
取该固体于试管中,加水、振荡 | 固体不溶解 |
取该固体于试管中,加盐酸、振荡 | 固体溶解,无气泡产生 |
一氧化碳通过炽热的该固体, 称固体质量、检测尾气 | 固体质量减轻,尾气中只检测到 CO 与 CO2 |
物质 | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
溶于水 | 无色、弱碱性 | 无色 |
加热 | 放出有臭味的气体 | 无反应 |
跟硝酸银溶液反应 | 生成浅黄色沉淀 | 生成白色沉淀 |
跟稀盐酸反应 | 放出红棕色的气体 | 无反应 |
选项 | 化学反应方程式 | 反应类型 | 气体性质 |
A | Fe+H2SO4=FeSO4+H2↑ | 置换反应 | 还原性 |
B | 2H2O2=2H2O+O2↑ | 分解反应 | 可燃性 |
C | 2KClO3=2KCl+3O2↑ | 化合反应 | 氧化性 |
D | CaCO3+2HCl=CaCl2+H2O+CO2↑ | 复分解反应 | 酸性 |


|
溶液指示剂 |
甲 |
乙 |
|
A |
黄色 |
蓝色 |
|
B |
无色 |
粉红色 |
 B .
B . 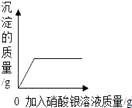 C .
C .  D .
D . 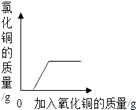
选项 | A | B | C | D |
甲 | 离子 | 茎 | 氧化反应 | 原子核 |
乙、丙、丁 | NH4+、K2MnO4、 Na+ | 树皮、韧皮部、 形成层 | 呼吸作用、铁生 锈、塑料老化 | 质子、电子、中子 |

选项 | 甲 | 乙 | 纵坐标 y |
A | 硝酸铜与硝酸银的混合溶液 | 锌粉 | 红色固体质量 |
B | 氯化铁与稀盐酸的混合溶液 | 氢氧化钠 | 沉淀质量 |
C | 不饱和氯化钠溶液 | 硫酸钾 | 溶质质量分数 |
D | 久置于空气中的氢氧化钠溶液 | 稀盐酸 | 气体质量 |
A.小苏打 B.硝酸钾 C.硫酸铜
①农田施用的复合肥料是;
②常用于治疗胃酸过多症的是;
③可用于游泳池杀菌消毒的是。


中的 X=。(用 ab 表示)
④加适量的稀 HCl,⑤加过量的 BaCl2 溶液,能达到目的的顺序是。
反应时间/s | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
滴入稀盐酸体积/mL | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
温度/℃ | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
。
,原因是。
【建立猜想】①两种酸溶液的 pH 不同。(注:pH 相同,则单位体积溶液中 H+数目相同)
②两种酸溶液中的不同。
【实验过程】
实验 次数 | 试剂 | 实验 条件 | 实验现象 |
① | 0.2 克 CuO 粉末+6 毫升 pH=0 的盐酸 | 常温 | 黑色粉末很快溶解, 溶液呈蓝绿色 |
② | 0.2 克 CuO 粉末+6 毫升 pH=0 的硫酸 | 常温 | 无明显现象 |
③ | 0.2 克 CuO 粉末+6 毫升 pH=0 的硫酸+0.35 克 NaCl | 常温 | 黑色粉末很快溶解, 溶液呈蓝绿色 |
④ | 0.2 克 CuO 粉末+6 毫升 pH=0 的硫酸+0.35 克 | 常温 | 无明显现象 |
根据上表你能得出什么结论?。
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】取一支试管,加入少量 AgNO3 溶液,再加入过量 NaCl 溶液,有白色沉淀生成。再往该试管中加入少量 KI 溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
或“小于”)。
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应。
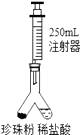
(规格为 250mL)活塞推到底部,再次连接装置。
设法使左右两管内的药品混合,反应结束后读取注射器读数为 220mL。
数据处理:计算得该珍珠粉中碳酸钙的质量分数为(CO2 密度为 2g/L,结果精确到 0.1%)。
理由是什么?。

【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
【实验过程】
①小金同学想利用 pH 试纸进一步测定白醋的酸碱度,正确的操作方法是。
②小金同学知道酸能够与铁发生化学反应产生氢气,但当他在铁钉中加入足量的白醋后, 并没看到有明显的气泡产生。小金同学很疑惑,于是提出猜想:气泡不明显可能与酸的浓度和种类有关。为了验证与酸的浓度有关,还缺少的试剂是(选填编号)。
A.1%的醋酸 B.3%的盐酸 C.5%的醋酸
③小金同学利用已有物品还想验证酸与碱的反应,请你帮助完成下列实验设计。
步骤 | 操作 | 现象 |
① | 将食品干燥剂加入适量清水中,充分反应 | |
② | 取步骤 1 中的上层清液,先加入牵牛花汁液, | 溶液由蓝色变为紫色,最后变为 红色 |
【评价反思】科学来源于生活,生活中的一些物品能更好地帮助我们学习和理解科学。
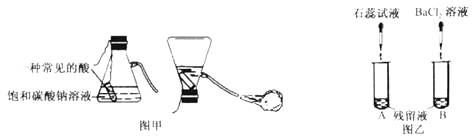
15℃、101kPa 下,1 体积水约能溶解 1 体积的二氧化碳,A 和 B 中质地较软的塑料瓶容积相等,装置的气密性良好,且充满 CO2。将 A 的瓶盖打开,加入体积约为塑料瓶容积 1/3 的蒸馏水,迅速旋紧瓶盖后充分振荡;向 B 中也注入体积约为塑料瓶容积 1/3 的蒸馏水,充分振荡。

①A 中观察到的实验现象是,其原因是。
②B 中观察到的实验现象是,其原因是。
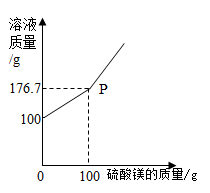
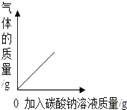
①P 点意义。
②反应生成沉淀的最大质量为克;
③求原 BaCl2 溶液的溶质质量分数。

四组实验教据记录如下表。请分析计算:
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
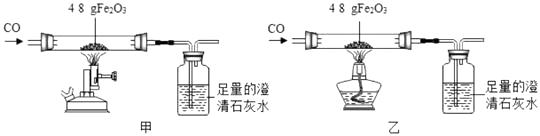
甲组用酒精喷灯(火焰温度 800℃~1000℃)、乙组用酒精灯(火焰温度 500℃~700℃) 分别对玻璃直导管进行充分加热,红色粉末均变为黑色粉末。两组分别用固体产物进行实验,记录如下。
操作步骤 | 甲组现象 | 乙组现象 |
① 称量反应后粉末质量(g) | 33.6 | 44.2 |
② 取黑色粉末用磁铁吸引 | 全部能被磁铁吸引 | 部分能被磁铁吸引 |
③ 取黑色粉末加入足量稀盐酸,震荡 | 全部溶解,有气泡 | 部分溶解,无气泡 |
为解释这个现象,小金同学查阅到下列资料:
Ⅰ.已知铁的氧化物有 FeO、Fe3O4、Fe2O3 , 在一定条件下,均能失去或逐步失去其中的氧,最终被还原为铁。
Ⅱ.Fe3O4 是一种铁氧体磁性物质,不溶于水和酸。