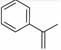
 ),下列说法正确的是( )
),下列说法正确的是( )
| A | B | C | D |
| | | | |
| 混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
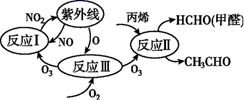
下列说法正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯中加入少量溴水、振荡,水层变成无色 | 苯与溴水发生取代反应 |
| B | 向久置的Na2SO3溶液中加入足量BaCl2溶液, 出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| C | 向溶液中加入少量盐酸生成白色沉淀 | 溶液中一定含有 |
| D | SO2通入含酚酞的NaOH溶液中,红色消失 | SO2有漂白性 |
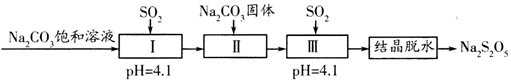
资料:Na2S2O5通常是由NaHSO3过饱和溶液经结晶脱水制得,下列说法正确的是( )
|
步骤 |
操作及现象 |
|
① |
取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
|
② |
向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
|
③ |
向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
H2CS3是(填“强”或“弱”)酸。
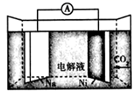
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol·L-1的稀H2SO4 , 关闭活塞。

已知:CS32- +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
仪器M的名称是。反应开始前需要先通入一段时间N2 , 其作用为。
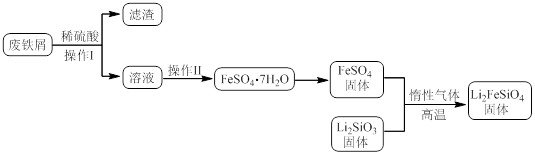
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
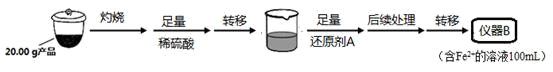
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH
已知:CO燃烧热的ΔH1=-283.0kJ/mo1
N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ/mo1,则ΔH= 。

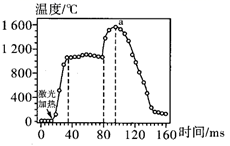
①如果将图中B点的平衡状态改变为C点的平衡状态,应采取的措施是。
②图中B、D两点对应的实验温度分别为TB和TD , 通过计算判断:TBTD(填“>”“=”或“<”)。
①K2S2O8水解时生成 H2O2和 KHSO4 , 写出该反应的化学方程式:。
②过二硫酸钾可通过电解 KHSO4溶液的方法制得。电解液中含硫微粒主要存在形式与pH 的关系如图2所示。
已知在阳极放电的离子主要是 HSO ,阳极区电解质溶液的pH 范围为 ;阳极的电极反应式为。


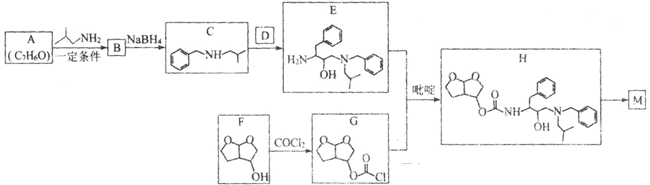
已知:① R1
![]() N
N ![]() R2(R1、R2表示氢原子或烃基)
R2(R1、R2表示氢原子或烃基)
②
![]() NR1R2
NR1R2
请回答: