 )的六氨基(-NH2)取代物有3种
D . 烷烃
)的六氨基(-NH2)取代物有3种
D . 烷烃  的符合题意命名是2-甲基-3-丙基戊烷
的符合题意命名是2-甲基-3-丙基戊烷
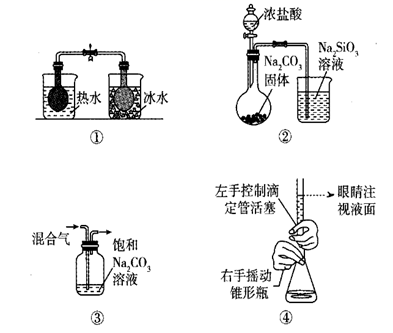
| 选项 | 实验操作 | 实验现象 |
| A | 向蔗糖中加入浓硫酸,并将产生的气体通过足量溴水 | 蔗糖变黑,膨胀,溴水褪色,有气泡冒出 |
| B | 将少量硼酸滴入 | 有气泡产生 |
| C | 向盛有 | 溶液由黄色变为浅绿色 |
| D | Mg和盐酸反应,将温度计水银球插入反应液中 | 镁条逐渐溶解,产生气泡,温度计水银柱迅速上升 |
![]()
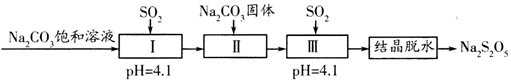
资料:Na2S2O5通常是由NaHSO3过饱和溶液经结晶脱水制得,下列说法正确的是( )
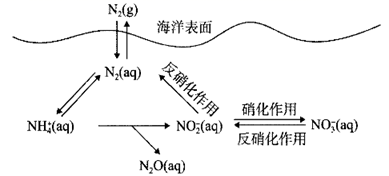
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=kJ·mol-1。

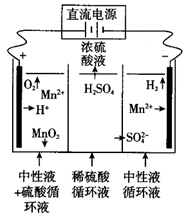
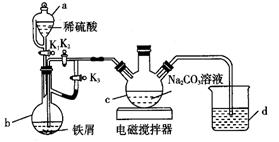
①写出电解时阳极的电极反应式:。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是。

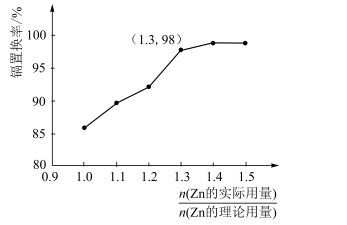
①实际生产中 比值最佳为1.3,不宜超过该比值的原因是。
②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为kg。
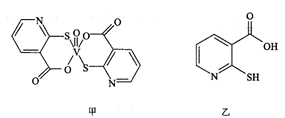
该药物中N原子的杂化方式是;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物(图甲)的原因是。

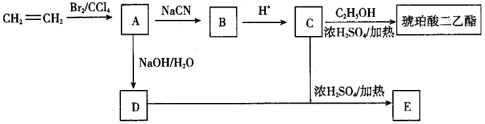
已知:①RBr+NaCN→RCN+NaBr;
②RCN+2H2O+H+→RCOOH+NH 。
完成下列填空: