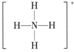
 D .
D . 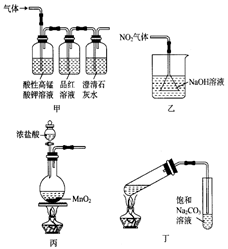
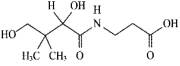 。下列关于维生素B5的说法正确的是( )
。下列关于维生素B5的说法正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向等物质的量浓度的 | 开始时得到红褐色沉淀 | 相同温度下 |
| B | 向 | 溶液变黄色 | 还原性: |
| C | 向2 mL等物质的量浓度的 | | 酸性: |
| D | 向2 mL 5%、2 mL 10%的双氧水中分别加入等物质的量的X、Y两种催化剂 | 加入Y催化剂的双氧水中产生气泡速率快 | 催化效果:Y>X |
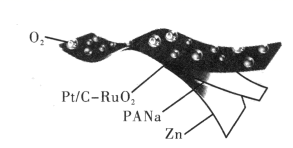
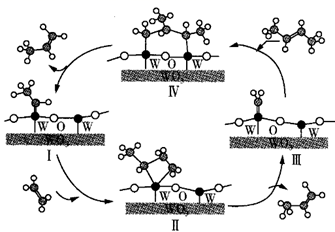
 C . 合成丙烯总反应的原子利用率为100%
D . 碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ过程中未发生断裂
C . 合成丙烯总反应的原子利用率为100%
D . 碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ过程中未发生断裂

仪器a的名称是,装置D的作用是(用离子方程式表示)。
生成的可能原因:①
氧化
;②(用离子方程式表示)。为探究
产生的原因,设计以下方案:
| 方案甲 | 取少量溶液a,滴加KSCN溶液至过量,溶液量红色 |
| 方案乙 | 用KOH浓溶液充分洗涤C中所得晶体,再用KOH稀溶液将 |
由方案甲中溶液变红知溶液a中含有(填离子符号),但该离子不一定是 将
氧化所得,还可能由产生(用离子方程式表示)。方案乙可证明酸性条件下
氧化
产生
。

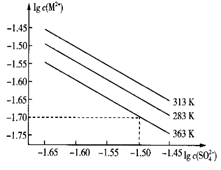
①压强p1、P2、P3由小到大的顺序是。
②T1℃,若向该容器中充入3.0 mol 和3.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,
,则N点的
。
③X、Y、M、N四点,平衡常数从大到小关系是。
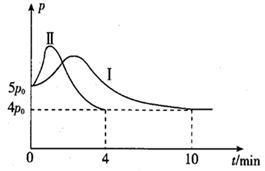
①曲线Ⅱ所对应的改变的条件可能为。
②体系总压强先增大后减小的原因为。
③该条件下 的平衡转化率为%(结果保留一位小数)。
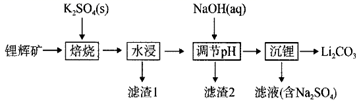
已知:① 的
,
的
,溶液中离子浓度小于
时,即认为沉淀完全。
②碳酸锂在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
回答下列问题:
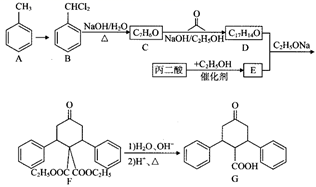
已知:① 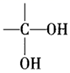 →
→ ![]() +H2O;
+H2O;
②R1CHO+R2CH2CHO
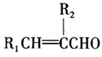 +H2O(
+H2O( 、
为烃基或H);
③ 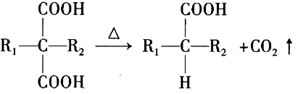 (
( 和
代表烷基)。
回答下列问题: