①HF(aq)+OH-(aq) = F-(aq)+H2O(l) ΔH=a kJ·mol-1
②H3O+(aq)+OH-(aq) = 2H2O(l) ΔH=b kJ·mol-1
③HF(aq)+H2O(l)⇌H3O+(aq)+F-(aq) ΔH=c kJ·mol-1
④F-(aq)+H2O(l)⇌HF(aq)+OH-(aq) ΔH=d kJ·mol-1
已知:a<b<0,下列说法正确的是( )

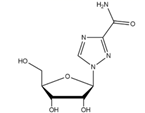
组成A的元素的元素符号为;G的化学式为。
新制氯水与Na2S2O3溶液反应的离子方程式为。
CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
请回答:


①在0~30min内,不同催化剂下二甲醚的产量大小关系为:III(填“>”、“<”或“=”)。
②工业上选择适合的硅铝比为0.15,说明其原因

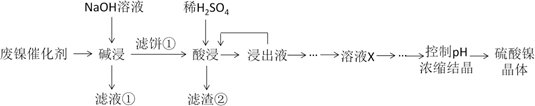
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀pH | 8.7 | 4.7 | 3.2 | 9.0 |
②CaF2的溶解度小于CaC2O4
③NiSO4·7H2O易溶于水,难溶于乙醇
回答下列问题:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁元素;
第2步:向所得滤液中,充分反应后过滤,得“溶液X”;
第3步:,充分反应后过滤;
第4步:滤渣用,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
a.加入适量(NH4)2C2O4
b.加入适量NH4F溶液
c.调节滤液的pH>8.7
d.加入足量的H2O2 , 调节溶液pH为3.2~7.2
e.加入足量的氯水,调节溶液pH为3.2~7.2
f.用稍过量硫酸充分溶解后
①遇FeCl3溶液显紫色。
②核磁共振氢谱显示有4种不同化学环境的氢原子。