选项 | 现象或事实 | 解释与说明 |
A | 苹果放在空气中久置变黄和纸张久置变黄 | 二者变黄的原理相似 |
B | 用四氯化碳进行衣服的干洗 | 目的是节约用水 |
C | 钢铁制品和铜制品在空气中被腐蚀 | 二者既能发生吸氧腐蚀又能发生析氢腐蚀 |
D | 形成黄河入海口沙洲、用卤水点豆腐 | 都体现了胶体聚沉的性质 |
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
C | 常温下,Ksp(AgCl)=1.8×10﹣10、 Ksp(AgBr)=5.4×10﹣13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时, |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
6种一溴二甲苯的熔点/℃ | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
对应二甲苯的熔点/℃ | 13 | ﹣54 | ﹣27 | ﹣54 | ﹣27 | ﹣54 |
由此推断熔点为234℃的一溴二甲苯可能是( )
 B .
B .  C .
C . 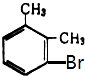 D .
D . 
 如图表示室温下,用0.1mol•L﹣1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH
如图表示室温下,用0.1mol•L﹣1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH  如图表示2SO2(g)+O2(g)⇌2SO3(g)△H<0,正逆反应的平衡常数随温度的变化
C .
如图表示2SO2(g)+O2(g)⇌2SO3(g)△H<0,正逆反应的平衡常数随温度的变化
C .  如图表示反应2NH3(g)⇌3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D .
如图表示反应2NH3(g)⇌3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D .  如图表示AgCl(s)⇌Ag+(aq)+Cl﹣(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
如图表示AgCl(s)⇌Ag+(aq)+Cl﹣(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
Ce(OH)CO3+O2=CeO2+CO2+H2O
②已知在一定条件下,电解熔融状态的CeO2可制备Ce,在阴极获得铈,写出阴极的电极反应式;

①得到滤渣B时,需要将其表面杂质洗涤干净.检验滤渣B已经洗涤干净的方法是.
②反应①的离子方程式为.
③如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.
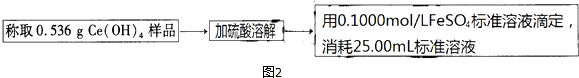
该产品中Ce(OH)4的质量分数为(保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度(“偏高”、“偏低”或“无影响”).
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)⇌2ClNO(g)△H3 K3
则△H3=(用△H1和△H2表示),K3=(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10﹣4 ,
那么室温下NO2﹣的水解常数Kh=,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH﹣ )、c(NO2﹣ )、c(HNO2)的大小顺序为.
时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
①由表中数据计算0~4min内v(NO2)=,该温度下的平衡常数K=(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2 , 测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):

则下列叙述正确的是.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm﹣3) | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1﹣苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | ﹣ | ﹣ | 1.076 | 溶 | 溶 | 不溶 |
乙醚 | ﹣116.3 | 34.6 | 0.713 | 微溶 | 溶 | ﹣ |

实验步骤:①在烧杯中加入15mL 95%的乙醇和0.1g硼氢化钠,搅拌下,再滴入8mL苯乙酮,控制温
度在48℃~50℃,滴加完毕,室温下放置15min.
②在搅拌的条件下,慢慢滴加6mL 3mol/L的盐酸.
③水浴加热,使反应液中大部分乙醇蒸出,出现分层,再加入10mL乙醚.将混合反应液倒入分液漏
斗,分离上述液体,水层再用10mL乙醚萃取,合并两次分液得到的有机相.
④加入适量无水硫酸镁,静置片刻,过滤除去硫酸镁固体.再加入0.6g无水碳酸钾,然后进行简单蒸
馏除去乙醚.
⑤经减压蒸馏得到1﹣苯乙醇4.5g(减压蒸馏可降低有机物的沸点).
a.酒精灯加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热.
已知:R﹣Cl RCH(COOC2H5)2
![]() RCH2COOH
RCH2COOH
以化合物A(分子式为C7H7Cl)为原料合成5﹣氯﹣2,3﹣二氢﹣1﹣茚酮(化合物F)工艺流程如下:
A B

![]() D
D


CH3CH2OH CH2=CH2
![]()