序号 | 名称 | 抑酸成分 | 主要成分含量/片 |
① | INDICALM | CaCO3 | 250mg |
② | Stamachease | Al(OH)3 | 250mg |
③ | Fash digestion | MgO | 250mg |

a.氢化物稳定性:H2O>NH3 b.沸点:H2O>NH3
c.NO中N为+2价,O为﹣2价 d.碱性:NH3>H2O.
已知:H2CO3=4.3×10﹣7 =5.6×10﹣11 .
Fe3++H2O⇌Fe(OH)2++H+K1
Fe(OH)2++H2O⇌Fe(OH)2++H+K2
Fe(OH)2++H2O⇌Fe(OH)3+H+K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是.
欲使平衡朝正反应方向移动,可采用的方法是.
a.降温b.加水稀释c.加入NH4Cld.加入NaHCO3 .
如图是实验室制备1,2﹣二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).有关数据列表如下:
|
|
乙醇 |
1,2﹣二溴乙烷 |
乙醚 |
|
状态 |
无色液体 |
无色液体 |
无色液体 |
|
密度/g/cm3 |
0.79 |
2.2 |
0.71 |
|
沸点/℃ |
78.5 |
132 |
34.6 |
|
熔点/℃ |
﹣130 |
9 |
﹣116 |
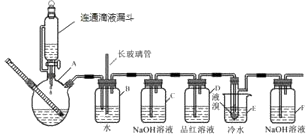
方案一:滴定法(用酸性KMnO4溶液滴定),主要步骤如下:
①取一定量补血剂样品,溶解除去不溶物(不损耗铁元素),并配制成250mL待测溶液;
②量取25.00mL待测溶液于锥形瓶中;
③用酸化的0.0100mol/LKMnO4溶液滴定至终点,记录消耗KMnO4溶液体积,重复一到两次实验.
(已知:5Fe 2++MnO4﹣+8H+→5Fe 3++Mn2++4H2O).

步骤①加入1mL稀硫酸的目的是.
(合成路线常用表示方法为:A B…
目标产)