
| 实验目的 | 实验方案 | |
| A | 验证H2O2具有氧化性 | 向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色 |
| B | 证明铜与浓硫酸反应有SO2生成 | 将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口 |
| C | 比较Ksp(AgI)与Ksp(AgCl) 的大小关系 | 向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊 |
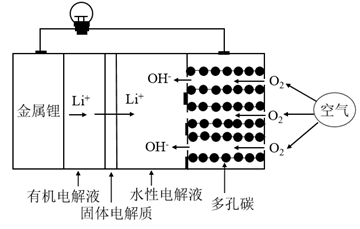

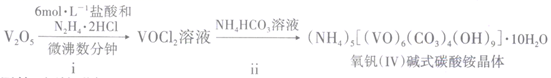
回答下列问题:
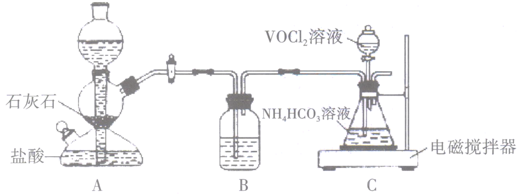
①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2 , 目的是。
②装置B中的试剂是。
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是,用无水乙醇洗涤的目的是。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为: +Fe2++2H+=VO2++Fe3++H2O
①KMnO4溶液的作用是
②滴定终点时的现象为
③粗产品中钒的质量分数的表达式为
第一次氧化: NaCN与NaClO反应,生成NaOCN和NaCl;
第二次氧化: NaOCN与NaClO反应,生成N2和两种盐(其中一种为酸式盐)。
已知HCN是一种苦杏仁味的无色剧毒液体(常温时,Ka=6.3×10-10),易挥发;HCN、HOCN中N元素的化合价相同。
①第一次氧化时,溶液应调节为 (填 “酸性”“碱性 ”或“中性"), 原因是。
②第二次氧化反应的离子方程式为
③常温下,0.1 mol•L-1 HCN溶液中,c(H+)=(列出计算式)。
一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g)
CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
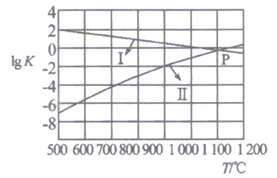
A.低温低压 B.低温高压 C.高温高压 D.高温低压
SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
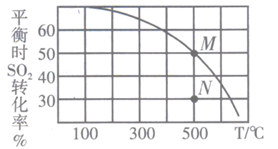
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
A. H2O B. CO2 C. SO2 D. CH4
①与B具有相同官能团且能发生银镜反应:
②核磁共振氮谱有3组峰,且峰面积之比为6:1:1