| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液中存在 |
| B | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 得到蓝色溶液 | 蔗糖水解的产物没有还原性 |
| C | 将 | 溶液分层,下层液体显紫红色 | 氧化性: |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应: |

有关信息如下表:
|
化学式 |
|
|
|
|
熔点/℃ |
232 |
246 |
|
|
沸点/℃C |
2260 |
652 |
114 |
|
其他性质 |
银白色固体金属 |
无色晶体, |
无色液体,易水解 |
a.114~232℃ b.232~652℃ c.652~2260℃ d.114~246℃
a.稀盐酸 b.酸性高锰酸钾溶液
c.滴有 溶液的
溶液 d.双氧水

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
|
序号 |
锂含量/% |
氧化剂 |
pH |
浸出液体Li浓度/(g·L-1) |
浸出渣中Li含量/% |
|
1 |
3.7 |
H2O2 |
3.5 |
9.02 |
0.10 |
|
2 |
3.7 |
NaClO3 |
3.5 |
9.05 |
0.08 |
|
3 |
3.7 |
O2 |
3.5 |
7.05 |
0.93 |
|
4 |
3.7 |
NaClO |
3.5 |
8.24 |
0.43 |
已知:
甲烷直接将 还原为
的热化学方程式为。
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有(写出一种即可)。
②此条件下达到平衡时,计算该反应的平衡常数 。
①常温下,相同浓度的 、
溶液中pH较大的是溶液。
②常温下, 显性(填“酸”“碱”或“中”),判断的理由是: (通过计算说明)。
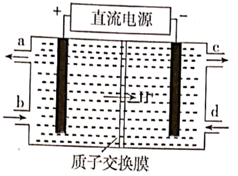
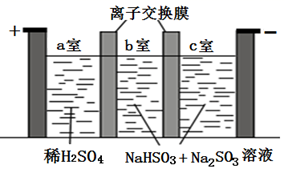
① 从电解槽的(填字母代号)口流出。
②写出阴极的电极反应式:。
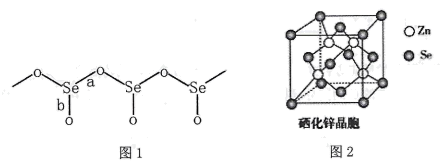
①图1中Se-O键键长较短的是 (填“a"或“b"),其原因是。
②SeO2熔点为350℃,固态SeO2属于晶体,其熔点远高于SO2(-75.5℃)的原因是 。

已知:① 
RCHO+R′CHO;
②RCHO+R′CH2CHO
![]() +H2O
+H2O
③ ;
请回答下列问题:
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。