 D . 乙醇的分子式:CH3CH2OH
D . 乙醇的分子式:CH3CH2OH

| A | B | C | D |
| 测量锌粒和3 mol/L硫酸反应生成H2的体积 | 制备并收集乙酸乙酯 | 加热熔融的纯碱固体 | 制取并收集SO2 |
| | | | |
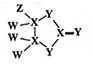

已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]- , 该配离子在乙醚(El2O, 沸点34.6℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeCl3溶液中通入足量的H2S | 生成两种沉淀 | Fe3+的氧化性强于S |
| B | 向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液 | 先出现浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| C | 向FeCl3溶液中滴入几滴30%的H2O2溶液 | 有气体产生,一段时间后,FeCl3溶液颜色加深 | Fe3+能催化H2O2 分解,且该分解反应为放热反应 |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
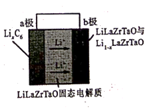
(电池总反应为: LixC6+LisxLaZrTaO LiLaZrTaO+6C)


已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常
用稳定剂吸收ClO2 , 生成NaClO2 , 使用时加酸只释放出ClO2一种气体;②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;③有关物质沸点如下表:
|
物质 |
CH3OH |
HCOOH |
ClO2 |
|
沸点 |
64.7 ℃ |
100.8 ℃ . |
11 ℃ |
请回答:

|
时间/s |
20 |
40 |
60 |
80 |
100 |
|
c(NO2)/(mol·L-1) |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
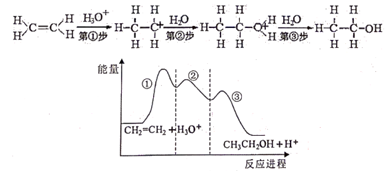
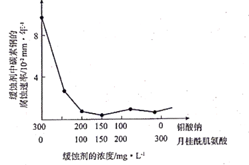
①0~40s内,v(NO2)=。
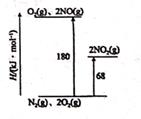
②达平衡时,反应体系吸收的热量为_ kJ(用Q表示)。
③该温度下反应2NO2(g)=N2O4(g)的化学平衡常数K=。
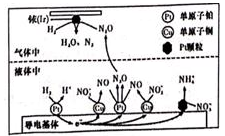
①Ir表面发生反应的方程式为。
②若导电基体上的Pt颗粒增多,造成的结果是。
①Ni(NH3)6]SO4中阴离子的立体构型是。
②在[NiNH3)6]SO4中Ni2+ 与NH3之间形成的化学键称为,提供孤电子对的成键原子是。

已知:①A的最简式为C2H5 , 分子中有两种氢原子且数目比为2:3;
②苯环上的烃基可被酸性KMnO4溶液氧化为一COOH
①遇氯化铁溶液发生显色反应
②能发生水解反应、银镜反应