 加热
B .
加热
B . 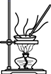 蒸发
D .
蒸发
D . 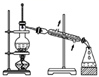 蒸馏
蒸馏
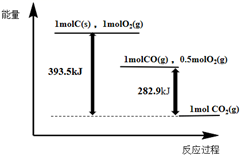
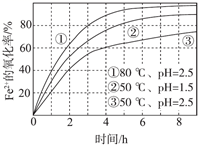
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是( )
|
实验目的 |
实验操作 |
|
|
A |
比较碳和硫两种非金属性的强弱 |
测同温同浓度下Na2CO3和Na2SO3水溶液的pH并比较pH大小 |
|
B |
证明浓硫酸具有吸水性 |
在蔗糖中滴加浓硫酸,蔗糖变黑 |
|
C |
配制0.400 mol/L NaOH溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,并马上转移至250 mL容量瓶定容 |
|
D |
比较水和乙醇中羟基上氢的活泼性 |
分别将少量钠投入到盛有水和乙醇的烧杯中 |
下列说法错误的是( )
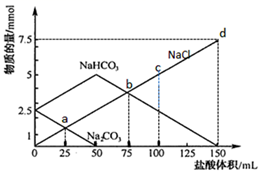

下列说法错误的是( )
①请写出NH3的电子式:
②肼溶于水显弱碱性,其原理与氨相似。请用电离方程式解释肼的水溶液显碱性的原因是:
③请写出上述制备肼的化学方程式:
 )互为同系物
C . 一定条件下,A可被直接氧化为D
D . 用NaOH溶液可以区分B、D、F
)互为同系物
C . 一定条件下,A可被直接氧化为D
D . 用NaOH溶液可以区分B、D、F
| 化学键 | C—H | H—H | H—O |
| 键能kJ/mol | b | c | d |
|
时间/min |
0 |
10 |
20 |
40 |
50 |
60 |
|
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
0.10 |
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变 d.1mol CO2生成的同时有4mol H-H键断裂
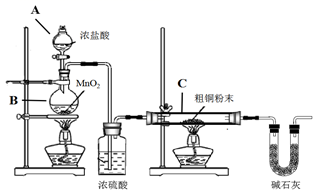
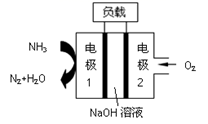
① B装置中发生反应的化学方程式是
② 装置C中粗铜粉末(含杂质Fe)与气体充分反应时的生成物是
③ 反应完成后,将C中的固体用稀盐酸完全溶解,再调节pH值除杂,经一系列操作便可获得CuCl2·2H2O晶体。溶解C中生成物固体时,有时会加入少量双氧水,目的是
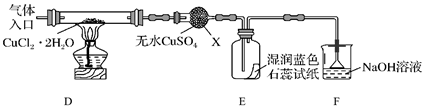
已知: ![]()
④仪器X的名称是
⑤实验操作的先后顺序是a→→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
⑥装置F中NaOH溶液的作用是。
⑦ 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。请分析产生CuCl2杂质的原因是
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请计算: