


下列叙述错误的是( )

| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.60×10-12 | 2.80×10-39 |


下列说法错误的是( )
| 容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
| HCl | O2 | Cl2 | H2O | |||||
| I | 恒温恒容 | 1L | | 4 | 1 | 0 | 0 | 1 |
| II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
| III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
|
电离平衡常数 |
1.8×10-5 |
K14.3×10-7 K25.6×10-11 |
3.0×10-8 |
回答下列问题:
a.CO b.ClO-c.CH3COO-d.HCO
a.CO +CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO +2HClO

则HX的电离平衡常数 (填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)醋酸溶液中水电离出来的c(H+),理由是。

①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。

②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
| 金属阳离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 1.5 | 4.0 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 7.7 | 9.5 |
回答下列问题:
已知Ksp[Co(OH)2]=2.0×10-16 , Ksp[Fe(OH)3]=4.0×10-38。

a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是。
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2 , 该过程的离子方程式是。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是。
②上述方式使处理后海水pH升高的原因是。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为。
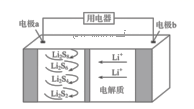
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:。充电时Li+向(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是。

① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率= ![]() ×100%)分析300 ℃后,固体残留率变化的原因是。
×100%)分析300 ℃后,固体残留率变化的原因是。