| 化学式 | 电离常数(25℃) |
| CH3COOH | K1=1.7×10-5 |
| HClO | K1=3.0×10-8 |
| H2CO3 | K1=4.3×10-7K2=5.6×10-11 |
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 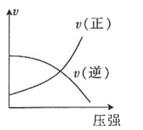


CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是( )
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:( )
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol·L-1 | 0.08 | a | b |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |

|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=(保留小数点后一位).
②上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母).
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计

|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积 |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=。

| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3的物质的量 |
仪器自选,供选的试剂:CO2、SO2、Na2CO3、NaHCO3、KMnO4、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
A.NaOH固体 B.氯化铁固体 C.水 D.碳酸钠固体
已知Ksp(BaA)=1.8×10-10 , 往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为mol·L-1。(忽略A2-的水解)