 称量NaOH固体
B .
称量NaOH固体
B .  氧气验满
C .
氧气验满
C .  制取CO2
D .
制取CO2
D .  过滤
过滤
| 选项 | 混合物的分离或提纯 | 分离物质的原理 |
| A | 除去粗盐中的泥沙 | 氯化钠和泥沙的溶解性不同 |
| B | 将石油分馏得到石油产品 | 石油中各成分的密度不同 |
| C | 分离硝酸钾和氯化钠组成的混合物 | 硝酸钾和氯化钠分解温度不同 |
| D | 分离液态空气制取氧气 | 利用氮气和氧气的熔点不同 |
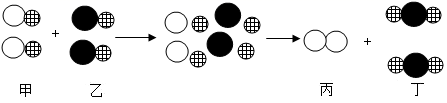
| 实验目的 | 实验操作 | |
| A | 区别蚕丝与棉线 | 取样,灼烧,辨别气味 |
| B | 鉴别 H2SO4 溶液和 NaOH 溶液 | 取样,滴加酚酞溶液,观察现象 |
| C | 区别硬水和软水 | 取样,加肥皂水,振荡,观察现象 |
| D | 配制 100g 溶质质量分数为 20%的盐酸 | 将 20g 浓盐酸加入 80g 水中,充分搅拌 |



①关闭K,通入氢气,点燃。为保证安全,点燃氢气之前应先。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开K,通入氧气,火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与氧气的有关。
A  木制杯垫
木制杯垫
B  塑料衣架
塑料衣架
C  纯银手镯
纯银手镯
D  羊毛地毯
羊毛地毯

资料:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
操作①的名称是。
提炼出的贵金属可制作奖牌,其成分是。
调节pH的主要目的是除去滤液中(填金属离子符号)。
写出粗铜中的铜与过量的稀硫酸和过氧化氢的混合溶液发生反应的化学方程式:。
(提出问题)实验的烧杯中溶质含有哪些物质?
猜想二:溶质中可能是Na2SO4和NaOH
猜想三:溶质中可能是。
|
方法步骤 |
实验现象 |
实验结论 |
|
|
方案一 |
取少量烧杯中的溶液于洁净的试管中,滴入几滴无色酚酞溶液 |
酚酞不变红色 |
猜想一正确 猜想二不正确 |
|
方案二 |
取少量烧杯中的溶液于洁净的试管中,滴加BaCl2溶液 |
出现白色沉淀 |
猜想三正确 |
|
方案三 |
取少量烧杯中的溶液于洁净的试管中,加入少量的黑色CuO粉末,并振荡 |
|
猜想三正确 |
(实验探究)小宇同学设计如下的实验方案。
(方案评价)同学们对小宇上述的方案讨论后认为:
方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是。
(查阅资料)
① ,该反应为放热反应。
②饱和硫酸亚铁溶液能吸收氧气;稀硫酸能吸收氨气。
③在常温下或温度不高的条件下镁几乎与水不反应。
(实验)
制备氮化镁的装置示意图如图(A-G)

G装置的作用是。
氮化镁是浅黄色粉末,极易与水反应生成Mg(OH)2沉淀和NH3 , 反应的化学方程式为,氮化镁(Mg3N2)中氮元素的化合价是。
步骤一:取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成。
步骤二:弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡,该步骤中产生气泡的化学方程式。
按图(H-1)实验装置进行实验:

利用该实验测定Mg3N2样品的纯度,除了要称量样品质量,还需获取的数据是,实验前必须检查该装置气密性,简述你的操作步骤。
|
碳酸氢钠片的质量/g |
足量稀盐酸的质量/g |
反应前总质量/g |
反应后总质量/g |
m(CO2)/g |
|
3.0g |
193.8g |
192.7g |
求该碳酸氢钠片样品中碳酸氢钠的含量。